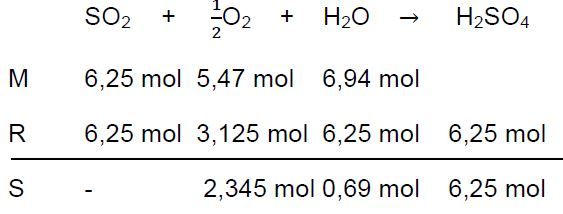Iklan
Pertanyaan
Asam sulfat H 2 SO 4 dibuat dengan mereaksikan 400 gram SO 2 , 175 gram O 2 dan 125 gram H 2 O . Reaksi berlangsung menurut persamaan reaksi (belum setara) SO 2 ( g ) + O 2 ( g ) + H 2 O ( l ) → H 2 SO 4 ( a q ) Pernyataan yang tidak benar adalah ...
Asam sulfat dibuat dengan mereaksikan 400 gram , 175 gram dan 125 gram . Reaksi berlangsung menurut persamaan reaksi (belum setara)
Pernyataan yang tidak benar adalah ...
Jika reaksi berlangsung sempurna, maka 6,25 mol
berubah menjadi 612,5 gram
merupakan pereaksi pembatas
Air terdapat dalam jumlah berlebih
Pada proses ini dihasilkan 700 gram
Pada akhir reaksi sisa Oksigen 75 gram
Iklan
I. Solichah
Master Teacher
1
4.8 (13 rating)
Medisya Vega
Makasih ❤️
Najwa Azalia Azzahra
Bantu banget Makasih ❤️
Siska sriwahyuni
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia