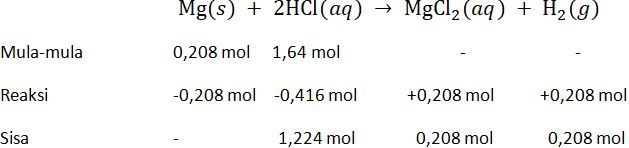Iklan
Pertanyaan
Logam magnesium dengan massa 5 gram direaksikan dengan larutan asam klorida yang mengandung HCI 60 gram. Reaksi yang terjadi adalah .... Tentukan: a. Pereaksi pembatas b. Berapa gram MgCl 2 yang terbentuk
Logam magnesium dengan massa 5 gram direaksikan dengan larutan asam klorida yang mengandung HCI 60 gram. Reaksi yang terjadi adalah ....
Tentukan:
a. Pereaksi pembatas
b. Berapa gram yang terbentuk
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
4.5 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia