Iklan
Pertanyaan
Asam malat ( C 3 H 5 O 3 COOH ) adalah asam lemah yang memberikan rasa masam dalam setiap minuman yang mengandung buah anggur atau apeI. Asam ini juga banyak digunakan sebagai larutan penyangga. Tentukan pH larutan yang dibuat dari 8,20 g natrium malat (berat molekul = 156,07 g/mol) yang ditambahkan ke dalam 500 mL larutan 0,125 M asam malat ( K a = 4 , 00 × 1 0 − 4 ) . Hitunglah pH larutan (a) tersebut jika ditambahkan 45,0 mL larutan HBr 0,500 M. Apakah sistem penyangga yang dibuat pada (a) merupakan buffer yang efektif? Jelaskan dengan singkat.
Asam malat adalah asam lemah yang memberikan rasa masam dalam setiap minuman yang mengandung buah anggur atau apeI. Asam ini juga banyak digunakan sebagai larutan penyangga.
- Tentukan pH larutan yang dibuat dari 8,20 g natrium malat (berat molekul = 156,07 g/mol) yang ditambahkan ke dalam 500 mL larutan 0,125 M asam malat .
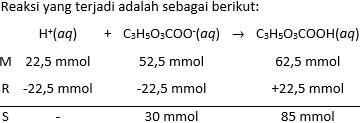
- Hitunglah pH larutan (a) tersebut jika ditambahkan 45,0 mL larutan HBr 0,500 M.
- Apakah sistem penyangga yang dibuat pada (a) merupakan buffer yang efektif? Jelaskan dengan singkat.
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia