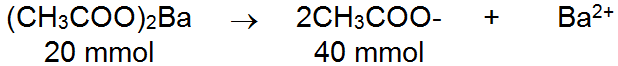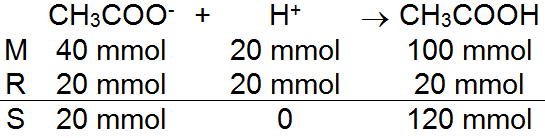Iklan
Pertanyaan
200 mL larutan CH 3 COOH 0,5 M dicampur dengan 100 mL larutan ( CH 3 COO ) 2 Ba 0,2 M. Jika K a CH 3 COOH = 1 , 0 × 1 0 − 5 , jika campuran ini ditambahkan 20 mL HCl 1M, maka pH larutan yang terjadi adalah ...
200 mL larutan 0,5 M dicampur dengan 100 mL larutan 0,2 M. Jika , jika campuran ini ditambahkan 20 mL 1M, maka pH larutan yang terjadi adalah ...
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
53
5.0 (7 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia