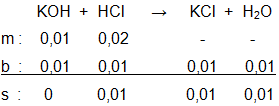Iklan
Pertanyaan
100 mL larutan KOH 0,1 M direaksikan dengan 100 mL larutan HCl 0,2 M . Persamaan reaksinya: KOH ( a q ) + HCl ( a q ) → KCl ( a q ) + H 2 O ( l ) Berapakah massa KCl yang terbentuk? ( A r K = 39 dan Cl = 35,5).
100 mL larutan KOH 0,1 M direaksikan dengan 100 mL larutan HCl 0,2 M. Persamaan reaksinya:
Berapakah massa KCl yang terbentuk? ( K = 39 dan Cl = 35,5).
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
17
4.7 (9 rating)
AH
Ahnaf Hafizh
Ini yang aku cari! Pembahasan lengkap banget Makasih ❤️ Mudah dimengerti Bantu banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia