Muhammad Y
29 Juli 2025 07:47
Iklan
Muhammad Y
29 Juli 2025 07:47
Pertanyaan
Titanium (IV) oksida merupakan senyawa berwarna putih yang dibuat dari asam sulfat dan mineral ilmenit (FeTiO3): FeTiO3 + H2SO4 → TiO2 + FeSO4 + H2O Jika direaksikan sebanyak 2.275 gram FeTiO3 dengan 980 gram H2SO4, maka berapa gram Titanium (IV) oksida yang dihasilkan?
Titanium (IV) oksida merupakan senyawa berwarna putih yang dibuat dari asam sulfat dan mineral ilmenit (FeTiO3):
FeTiO3 + H2SO4 → TiO2 + FeSO4 + H2O
Jika direaksikan sebanyak 2.275 gram FeTiO3 dengan 980 gram
H2SO4, maka berapa gram Titanium (IV) oksida yang dihasilkan?
7
1
Iklan
Patrick H
29 Juli 2025 12:58
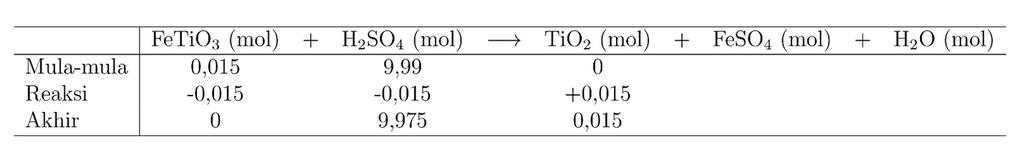
<p>Kita punya persamaan reaksi<br>FeTiO<sub>3</sub> + H<sub>2</sub>SO<sub>4</sub> → TiO<sub>2</sub> + FeSO<sub>4</sub> + H<sub>2</sub>O</p><p>Nampak bahwa persamaan reaksi tersebut sudah setara.</p><p>Terlihat bahwa tiap 1 mol FeTiO<sub>3</sub> dan 1 mol H<sub>2</sub>SO<sub>4</sub> menghasilkan 1 mol FeSO<sub>4</sub>.</p><p> </p><p>*Dari tabel periodik unsur, kita peroleh massa molar masing-masing unsur adalah Fe = 55,85 g/mol, Ti = 47,87 g/mol, S = 32,07 g/mol, O = 16,00 g/mol, dan H = 1,01 g/mol. Maka, massa molar FeTiO<sub>3</sub>, H<sub>2</sub>SO<sub>4</sub>, dan TiO<sub>2</sub> masing-masing adalah:</p><p>Mr FeTiO<sub>3</sub> = 55,85 g/mol + 47,87 g/mol + 3×16,00 g/mol = 151,72 g/mol</p><p>Mr H<sub>2</sub>SO<sub>4</sub> = 2×1,01 g/mol + 32,07 g/mol + 4×16,00 g/mol = 98,09 g/mol</p><p>Mr TiO<sub>2</sub> = 47,87 g/mol + 2×16,00 g/mol = 79,87 g/mol</p><p> </p><p>Jumlah pereaksi masing-masing adalah</p><p>mol FeTiO<sub>3</sub> = 2275 g / 151,72 g/mol = 0,015 mol</p><p>mol H<sub>2</sub>SO<sub>4</sub> = 980 g / 98,09 g/mol = 9,99 mol</p><p> </p><p>Karena jumlah FeTiO<sub>3</sub> lebih sedikit, maka FeTiO<sub>3</sub> menjadi pereaksi pembatas, sehingga jumlah TiO<sub>2</sub> maksimum yang mungkin dihasilkan hanyalah 0,015 mol.</p><p>Massa TiO<sub>2</sub> = 0,015 mol × 79,87 g/mol = <strong>1,2 gram</strong>.</p>
Kita punya persamaan reaksi
FeTiO3 + H2SO4 → TiO2 + FeSO4 + H2O
Nampak bahwa persamaan reaksi tersebut sudah setara.
Terlihat bahwa tiap 1 mol FeTiO3 dan 1 mol H2SO4 menghasilkan 1 mol FeSO4.
*Dari tabel periodik unsur, kita peroleh massa molar masing-masing unsur adalah Fe = 55,85 g/mol, Ti = 47,87 g/mol, S = 32,07 g/mol, O = 16,00 g/mol, dan H = 1,01 g/mol. Maka, massa molar FeTiO3, H2SO4, dan TiO2 masing-masing adalah:
Mr FeTiO3 = 55,85 g/mol + 47,87 g/mol + 3×16,00 g/mol = 151,72 g/mol
Mr H2SO4 = 2×1,01 g/mol + 32,07 g/mol + 4×16,00 g/mol = 98,09 g/mol
Mr TiO2 = 47,87 g/mol + 2×16,00 g/mol = 79,87 g/mol
Jumlah pereaksi masing-masing adalah
mol FeTiO3 = 2275 g / 151,72 g/mol = 0,015 mol
mol H2SO4 = 980 g / 98,09 g/mol = 9,99 mol
Karena jumlah FeTiO3 lebih sedikit, maka FeTiO3 menjadi pereaksi pembatas, sehingga jumlah TiO2 maksimum yang mungkin dihasilkan hanyalah 0,015 mol.
Massa TiO2 = 0,015 mol × 79,87 g/mol = 1,2 gram.
· 5.0 (1)
Iklan
Mau jawaban yang terverifikasi?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



