BB
Blackie B

10 Februari 2025 06:38
Iklan
BB
Blackie B

10 Februari 2025 06:38
Pertanyaan
Diketahui persamaan termokimia: C2H5OH(I) + 3O2(g) → 2CO2(g) + 3H2O(I); DeltaH = - 1460kJ Tentukan banyaknya kalor yang dibebaskan pada pembakaran sempurna 50 ml etanol (petanol = 0,69 g ml)
10
2
Iklan
FM
Falisha M
10 Februari 2025 15:47
Jawaban terverifikasi
Diketahui: ● ΔH=−1460 kJ (eksoterm) ● Volume etanol = 50 mL ● Massa jenis etanol = 0,69 g/mL ● Massa molar etanol = 46 g/mol Jawab: 1. Menghitung massa etanol massa = volume × massa jenis = 50 × 0,69 =34,5 g 2. Menghitung mol etanol mol etanol = massa / massa molar = 34,5 / 46 = 0,75 mol 3. Menghitung kalor yang dibebaskan Dari persamaan termokimia, 1 mol etanol membebaskan 1460 kJ. Maka 0,75 mol: Q = 0,75 × 1460 = 1095 kJ (kalor yang dibebaskan) 𝑄 = 0 , 75 × 1460 Q=0,75×1460 = 1095 kJ =1095 kJ
· 5.0 (1)
Iklan
JS
J. Siregar
11 Februari 2025 01:27
Jawaban terverifikasi
<p>Jawaban yang benar adalah Q = 1.095 kJ.</p><p> </p><p>Simak pembahasan terlampir berikut.</p>
Jawaban yang benar adalah Q = 1.095 kJ.
Simak pembahasan terlampir berikut.
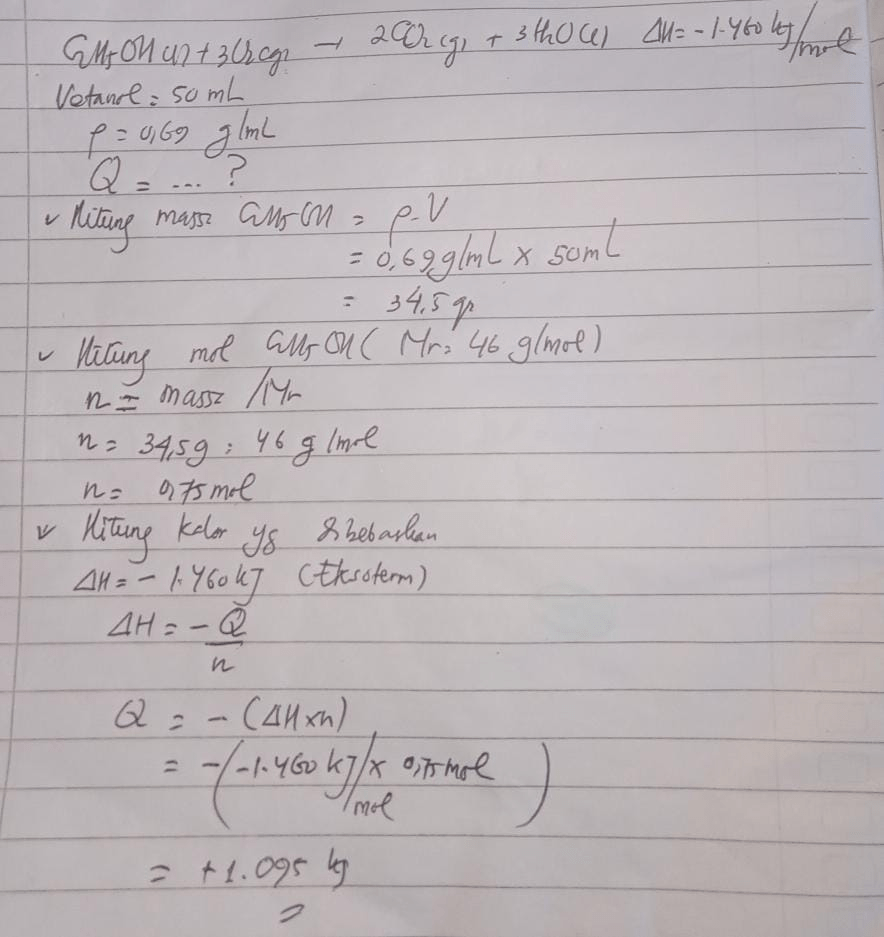
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



