Ayyndaa. A
30 Agustus 2024 11:36
Iklan
Ayyndaa. A
30 Agustus 2024 11:36
Pertanyaan
20ml asam cuka komersial mengandung asam asetat (ka=1.10^-2) dititrasi dengan NaOH 0,1N. a. indikator yang tepat adalah b. apa indikator yang tepat pada penetapan kadar HCl dengan standar NaOH? c. kekurangan teori Arhenius
20ml asam cuka komersial mengandung asam asetat (ka=1.10^-2) dititrasi dengan NaOH 0,1N.
a. indikator yang tepat adalah
b. apa indikator yang tepat pada penetapan kadar HCl dengan standar NaOH?
c. kekurangan teori Arhenius
1
2
Iklan
Qisara A
30 Agustus 2024 12:26
<p> </p><p>a. Pada titrasi asam cuka (yang merupakan asam lemah) dengan NaOH (basa kuat), titik ekivalen biasanya berada di pH yang sedikit di atas 7, sekitar pH 8-9. Oleh karena itu, indikator yang tepat untuk titrasi ini adalah fenolftalein. Fenolftalein berubah warna dari tidak berwarna menjadi merah muda pada pH sekitar 8,2 hingga 10, yang cocok dengan pH di sekitar titik ekivalen titrasi ini.</p><p>b. HCl adalah asam kuat dan NaOH adalah basa kuat. Pada titrasi asam kuat dengan basa kuat, titik ekivalen berada pada pH sekitar 7. Untuk titrasi ini, indikator yang tepat adalah metil jingga atau bromtimol biru. Metil jingga berubah warna dari merah ke kuning pada pH 3,1-4,4, sedangkan bromtimol biru berubah warna dari kuning ke biru pada pH 6,0-7,6.</p><p>c. Teori Arrhenius mendefinisikan asam sebagai zat yang meningkatkan konsentrasi ion H⁺ dalam air, dan basa sebagai zat yang meningkatkan konsentrasi ion OH⁻ dalam air. Namun, teori ini memiliki beberapa keterbatasan:<br>1. Terbatas pada pelarut air: Teori Arrhenius hanya berlaku pada reaksi dalam larutan air, dan tidak menjelaskan perilaku asam dan basa dalam pelarut non-air atau keadaan gas.<br>2. Tidak mencakup asam dan basa non-ionik: Teori ini tidak menjelaskan asam dan basa yang tidak menghasilkan ion H⁺ atau OH⁻ secara langsung, seperti AlCl₃ (asam) atau NH₃ (basa).<br>3. Tidak menjelaskan kekuatan asam dan basa: Teori ini tidak memberikan penjelasan yang memadai tentang perbedaan kekuatan antara asam atau basa kuat dan lemah.</p><p>Teori-teori yang lebih modern, seperti teori Brønsted-Lowry dan teori Lewis, dapat mencakup reaksi-reaksi yang lebih luas dan menjelaskan lebih banyak fenomena yang tidak dapat dijelaskan oleh teori Arrhenius.</p>
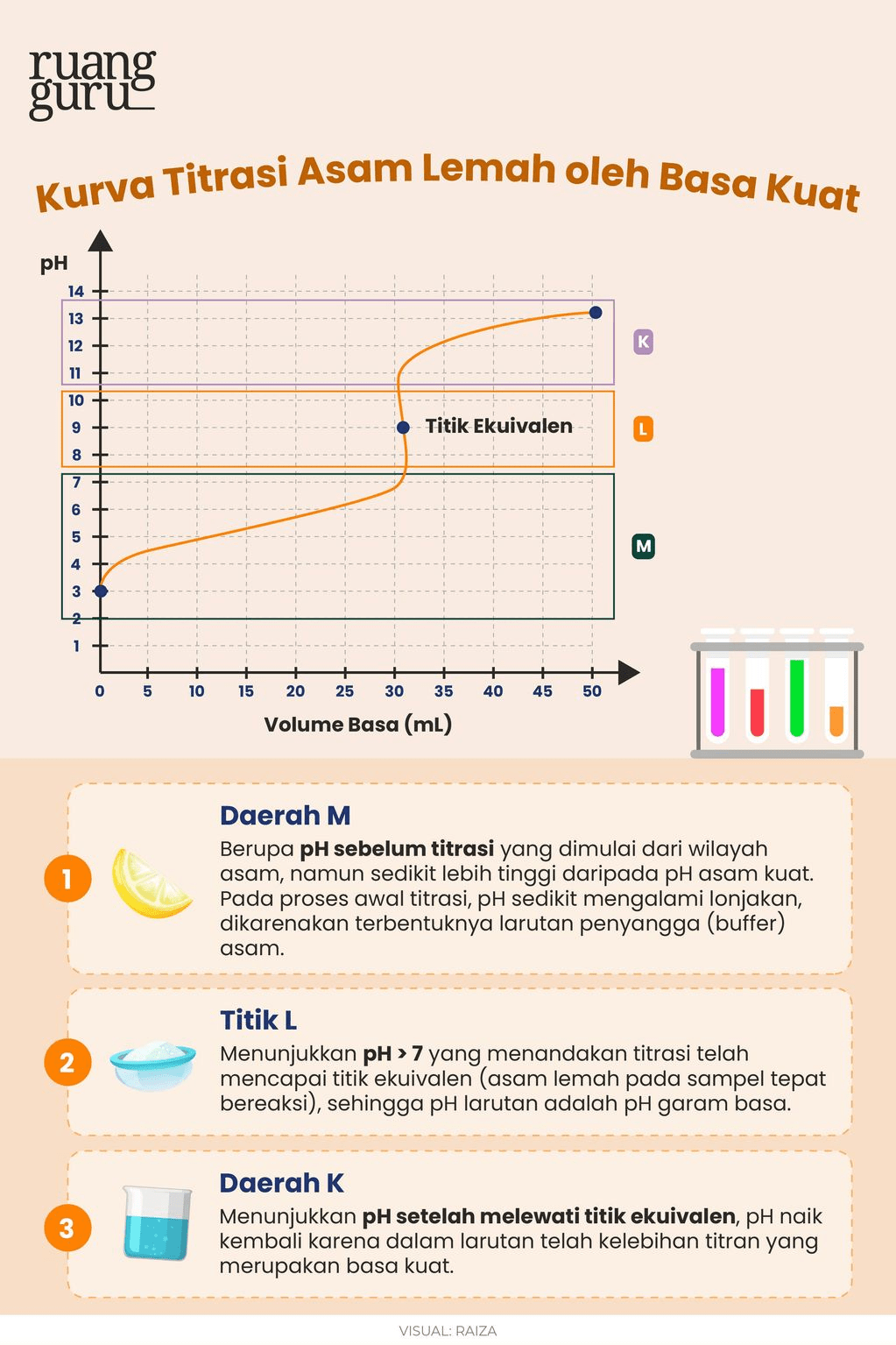
a. Pada titrasi asam cuka (yang merupakan asam lemah) dengan NaOH (basa kuat), titik ekivalen biasanya berada di pH yang sedikit di atas 7, sekitar pH 8-9. Oleh karena itu, indikator yang tepat untuk titrasi ini adalah fenolftalein. Fenolftalein berubah warna dari tidak berwarna menjadi merah muda pada pH sekitar 8,2 hingga 10, yang cocok dengan pH di sekitar titik ekivalen titrasi ini.
b. HCl adalah asam kuat dan NaOH adalah basa kuat. Pada titrasi asam kuat dengan basa kuat, titik ekivalen berada pada pH sekitar 7. Untuk titrasi ini, indikator yang tepat adalah metil jingga atau bromtimol biru. Metil jingga berubah warna dari merah ke kuning pada pH 3,1-4,4, sedangkan bromtimol biru berubah warna dari kuning ke biru pada pH 6,0-7,6.
c. Teori Arrhenius mendefinisikan asam sebagai zat yang meningkatkan konsentrasi ion H⁺ dalam air, dan basa sebagai zat yang meningkatkan konsentrasi ion OH⁻ dalam air. Namun, teori ini memiliki beberapa keterbatasan:
1. Terbatas pada pelarut air: Teori Arrhenius hanya berlaku pada reaksi dalam larutan air, dan tidak menjelaskan perilaku asam dan basa dalam pelarut non-air atau keadaan gas.
2. Tidak mencakup asam dan basa non-ionik: Teori ini tidak menjelaskan asam dan basa yang tidak menghasilkan ion H⁺ atau OH⁻ secara langsung, seperti AlCl₃ (asam) atau NH₃ (basa).
3. Tidak menjelaskan kekuatan asam dan basa: Teori ini tidak memberikan penjelasan yang memadai tentang perbedaan kekuatan antara asam atau basa kuat dan lemah.
Teori-teori yang lebih modern, seperti teori Brønsted-Lowry dan teori Lewis, dapat mencakup reaksi-reaksi yang lebih luas dan menjelaskan lebih banyak fenomena yang tidak dapat dijelaskan oleh teori Arrhenius.
· 5.0 (1)
Iklan
J. Siregar
31 Agustus 2024 03:17
<p><strong>Jawabannya adalah fenolftalein.</strong></p><p> </p><p>Titrasi asam lemah oleh basa kuat, berarti:</p><ul><li><strong>Titran</strong> (larutan standar pada <strong>buret</strong>) → <strong>basa</strong> <strong>kuat</strong></li><li><strong>Titrat</strong> (larutan sampel pada labu <strong>erlenmeyer</strong>) → <strong>asam</strong> <strong>lemah</strong></li></ul><p>Pada titrasi asam lemah CH<sub>3</sub>COOH dengan NaOH (basa kuat), titik ekivalen biasanya berada di pH yang sedikit di atas 7, sekitar pH 8 - 10. Indikator yang memiliki rentang pH tersebut adalah fenolftalein. Fenolftalein berubah warna dari tidak berwarna menjadi merah muda pada pH sekitar 8,2 hingga 10, yang cocok dengan pH di sekitar titik ekivalen titrasi ini.</p><p><strong><u>**Untuk poin lainnya bisa kamu posting kembali, 1 postingan = 1 pertanyaan.</u></strong></p><p> </p><p>Jadi, jawaban yang tepat adalah indikator fenolfatelin.</p>
Jawabannya adalah fenolftalein.
Titrasi asam lemah oleh basa kuat, berarti:
- Titran (larutan standar pada buret) → basa kuat
- Titrat (larutan sampel pada labu erlenmeyer) → asam lemah
Pada titrasi asam lemah CH3COOH dengan NaOH (basa kuat), titik ekivalen biasanya berada di pH yang sedikit di atas 7, sekitar pH 8 - 10. Indikator yang memiliki rentang pH tersebut adalah fenolftalein. Fenolftalein berubah warna dari tidak berwarna menjadi merah muda pada pH sekitar 8,2 hingga 10, yang cocok dengan pH di sekitar titik ekivalen titrasi ini.
**Untuk poin lainnya bisa kamu posting kembali, 1 postingan = 1 pertanyaan.
Jadi, jawaban yang tepat adalah indikator fenolfatelin.
· 0.0 (0)
Mau pemahaman lebih dalam untuk soal ini?
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!

LATIHAN SOAL GRATIS!
Drill Soal
Latihan soal sesuai topik yang kamu mau untuk persiapan ujian


Perdalam pemahamanmu bersama Master Teacher
di sesi Live Teaching, GRATIS!



