Iklan
Pertanyaan
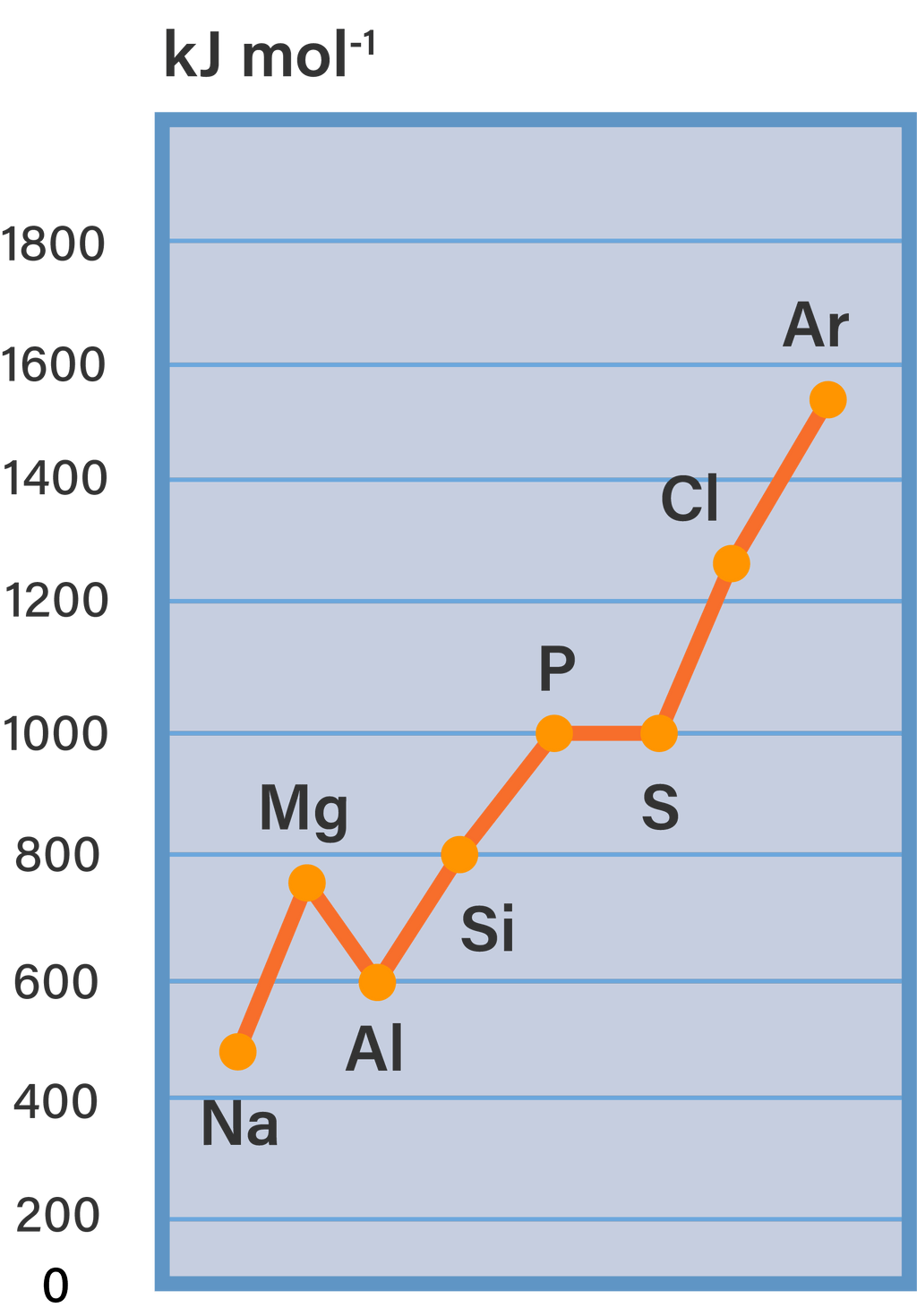
Unsur-unsur pada periode ke tiga terdiridari Na, Mg, AI, Si, P, Cl, dan Ar. Atas dasarkonfigurasi elektronnya, dapat dikatakanbahwa ....
Unsur-unsur pada periode ke tiga terdiri dari Na, Mg, AI, Si, P, Cl, dan Ar. Atas dasar konfigurasi elektronnya, dapat dikatakan bahwa ....
Si dapat bereaksi dengan asam kuat dan basa kuat
Energi ionisasi pertama Mg lebih besar dari AI
Ar merupakan unsur ion logam sangat elektronegatif
Na, Mg, dan AI merupakan oksidator kuat
P dan Cl cenderung membentuk basa
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
3
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia