Iklan
Pertanyaan
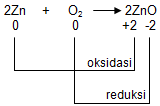
Tunjukkan bahwa reaksi berikut merupakan reaksi redoks! 2 Zn + O 2 → 2 ZnO
Tunjukkan bahwa reaksi berikut merupakan reaksi redoks!
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
3
4.0 (1 rating)
Bd
Baiq dian utami
Materinya mudah dipahami🤩🤩 terimakasih
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia