Untuk menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron (struktur Lewis). Struktur Lewis merupakan penggambaran distribusi elektron dalam suatu struktur molekul dengan menggunakan tanda elektron. Struktur Lewis memuat lambang atom yang di sekelilingnya terdapat tanda titik, silang, atau bulatan kecil yang menggambarkan elektron valensi atom yang berikatan. Struktur ini menggambarkan bagaimana peranan elektron valensi dalam membentuk ikatan.
Sebelum menggambarkan struktur Lewis senyawa NH3BF3, maka perlu diketahui elektron valensi dari unsur N, H, B dan F. Untuk menentukan elektron valensi, perlu dibuat konfigurasi elektronnya. Konfigurasi elektron dari atom N, H, B dan F adalah sebagai berikut.
1H5B7N9F====1s21s2 2s2 2p11s2 2s2 2p31s2 2s2 2p5
Berdasarkan konfigurasi elektron di atas, diketahui bahwa elektron valensi atom H adalah 1, elektron valensi atom B adalah 3, elektron valensi atom N adalah 5 dan elektron valensi atom F adalah 7. Pada senyawa NH3BF3, atom N berikatan dengan 3 buah atom H dan atom B berikatan dengan 3 buah atom F. Struktur Lewis dan struktur molekul dari senyawa NH3BF3 adalah sebagai berikut.
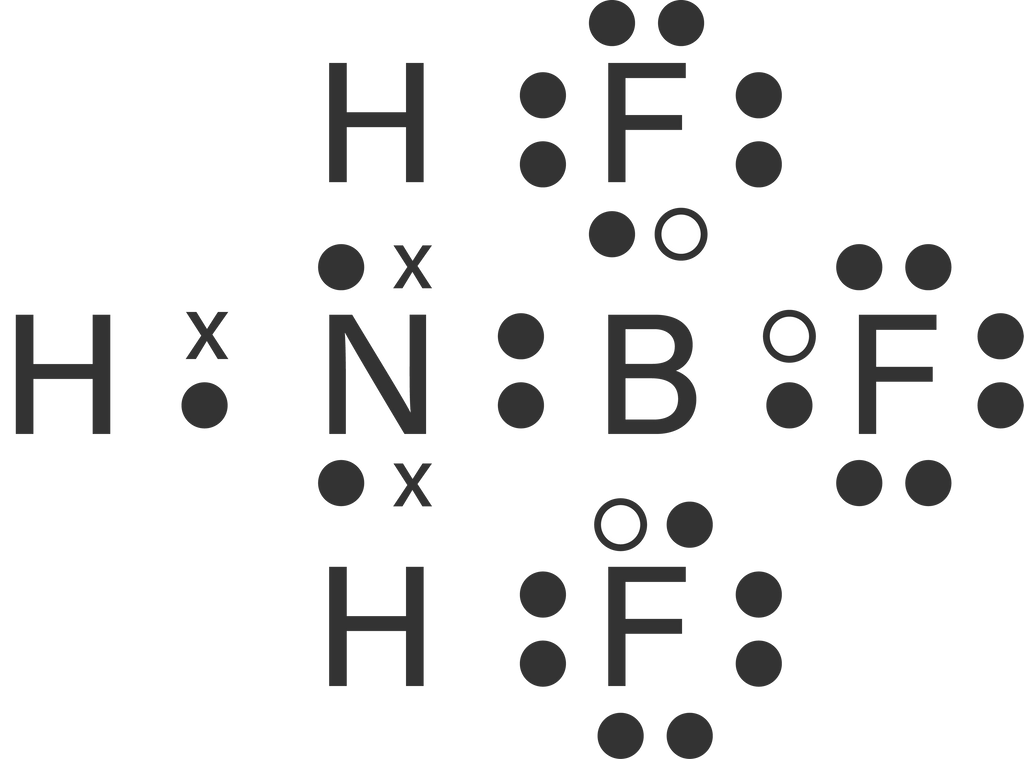
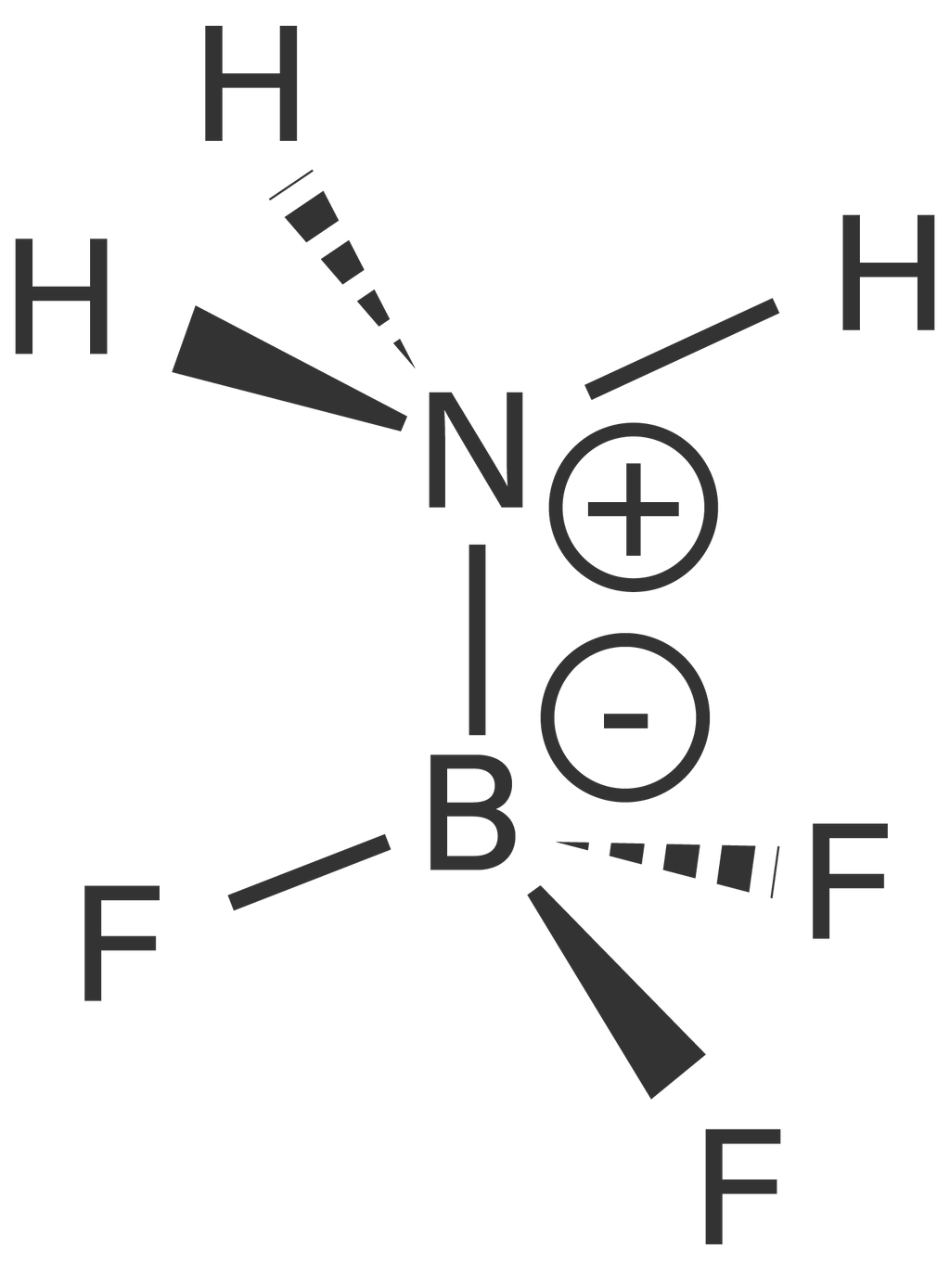
Atom nitrogen (N) memerlukan 3 buah elektron untuk memenuhi kaidah oktet, sedangkan setiap atom hidrogen (H) memiliki sebuah elektron. Setiap atom H menggunakan elektronnya bersama dengan masing-masing 1 elektron dari atom N, sehingga terdapat sepasang elektron bebas dan terbentuk senyawa NH3. Pada atom B yang memiliki 3 buah elektron, masing-masing elektronnya digunakan bersama dengan elektron dari atom F membentuk senyawa BF3. Senyawa NH3 dan BF3 berikatan dengan cara menggunakan pasangan elektron bebas dari NH3 untuk membentuk senyawa NH3BF3 dengan ikatan kovalen kordinasi.
Jadi, struktur Lewis dan struktur molekul dari senyawa NH3BF3 adalah sebagai berikut.





















