Struktur Lewis dan struktur molekul dari senyawa  adalah sebagai berikut.
adalah sebagai berikut.
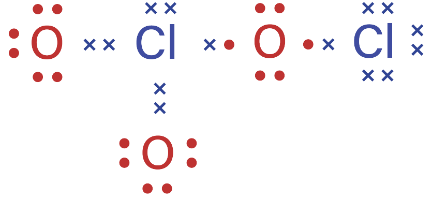
Struktur Lewis merupakan penggambaran distribusi elektron dalam suatu struktur molekul dengan menggunakan tanda elektron. Struktur Lewis memuat lambang atom yang di sekelilingnya terdapat tanda titik, silang, atau bulatan kecil yang menggambarkan elektron valensi atom yang berikatan. Struktur ini menggambarkan bagaimana peranan elektron valensi dalam membentuk ikatan.
Sebelum menggambarkan struktur Lewis senyawa  , maka perlu diketahui elektron valensi dari unsur O dan Cl. Untuk menentukan elektron valensi, perlu dibuat konfigurasi elektronnya. Konfigurasi elektron dari atom O dan Cl adalah sebagai berikut.
, maka perlu diketahui elektron valensi dari unsur O dan Cl. Untuk menentukan elektron valensi, perlu dibuat konfigurasi elektronnya. Konfigurasi elektron dari atom O dan Cl adalah sebagai berikut.
8O17Cl==1s2 2s2 2p4[10Ne] 3s2 3p5
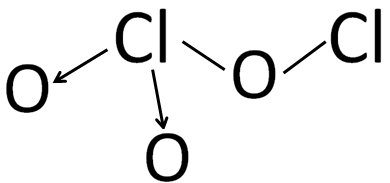
Berdasarkan konfigurasi elektron di atas, diketahui bahwa elektron valensi atom O adalah 6 dan elektron valensi atom Cl adalah 7. Pada senyawa  , 2 atom Cl berikatan dengan 3 buah atom O dan membentuk ikatan kovalen. Struktur Lewis dan struktur molekul dari senyawa
, 2 atom Cl berikatan dengan 3 buah atom O dan membentuk ikatan kovalen. Struktur Lewis dan struktur molekul dari senyawa  adalah sebagai berikut.
adalah sebagai berikut.


Atom klor (Cl) memerlukan sebuah elektron untuk memenuhi kaidah oktet dan memiliki 3 pasang elektron bebas. Pada gambar di atas, atom Cl di pusat menggunakan sebuah elektronnya bersama dengan 1 buah elektron dari atom O yang membentuk ikatan kovalen tunggal, serta 2 pasang elektron bebasnya digunakan bersama dengan 2 buah atom O membentuk ikatan kovalen kordinasi. Selain itu, atom Cl dan O lainnya saling menggunakan 1 buah elektron bersama membentuk ikatan kovalen tunggal. Jika diamati, semua atom dalam senyawa  telah mencapai kaidah oktet (8 elektron).
telah mencapai kaidah oktet (8 elektron).

















