Larutan penyangga adalah larutan yang memiliki harga pH yang cenderung stabil atau tetap pada penambahan sedikit asam dan/atau sedikit basa. Larutan penyangga terbagi atas 2 jenis, yaitu larutan penyangga asam dan larutan penyangga basa. Larutan penyangga asam terdiri dari suatu asam lemah dengan basa konjugasinya atau dalam bentuk garam dari basa konjugasinya, sedangkan larutan penyangga basa terdiri dari suatu basa lemah dengan asam konjugasinya atau dalam bentuk garam dari asam konjugasinya. Larutan penyangga juga dapat dibuat dengan cara tidak langsung, yaitu dengan mereaksikan asam lemah dengan basa kuat atau mereaksikan basa lemah dengan asam kuat dengan catatan jumlah mol asam kuat atau basa kuat harus lebih sedikit sehingga akan habis bereaksi seluruhnya dan menjadi pereaksi pembatas.
Pada soal di atas, larutan penyangga dibentuk secara tidak langsung yaitu dengan mereaksikan larutan asam lemah  dan basa kuat
dan basa kuat  . Campuran ini akan membentuk larutan penyangga asam dan memiliki nilai pH < 7. Sebelum dapat menentukan nilai pH larutannya, maka perlu dihitung terlebih dahulu mol asam lemah dan basa kuatnya dengan cara berikut:
. Campuran ini akan membentuk larutan penyangga asam dan memiliki nilai pH < 7. Sebelum dapat menentukan nilai pH larutannya, maka perlu dihitung terlebih dahulu mol asam lemah dan basa kuatnya dengan cara berikut:


Setelah diketahui mol masing-masing larutan, maka mol tersebut dimasukkan ke dalam persamaan reaksinya untuk dapat mengetahui zat yang habis bereaksi dan bersisa seperti berikut:
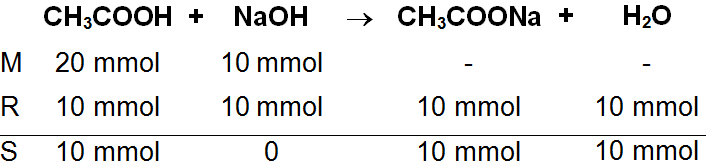
Berdasarkan persamaan di atas, diketahui bahwa basa kuat habis bereaksi dan tersisa asam lemah serta garamnya. Selanjutnya nilai pH larutan penyangga dapat dihitung dengan cara sebagai berikut.
CH3COONa→CH3COO−+Na+
[H+][H+][H+]pHpHpH======mol CH3COO−mol CH3COOH×Ka10 mmol10 mmol×1⋅10−51×10−5−log [H+]−log 1×10−55
Jadi, pH larutan penyangga tersebut adalah 5.
















