Titrasi merupakan suatu metode untuk menentukan kadar atau kemolaran zat di dalam larutan berdasarkan reaksi asam-basa. Titrasi dilakukan hingga titik ekuivalen tercapai. Titik ekuivalen merupakan titik saat asam-basa tepat habis bereaksi. Titik akhir titrasi ditandai dengan perubahan warna larutan indikator. Indikator adalah asam organik lemah atau basa organik lemah yang dapat berubah warna pada rentang harga pH tertentu. Indikator memiliki trayek perubahan warna yang berbeda-beda. Dengan demikian dari uji larutan dengan beberapa indikator akan diperoleh daerah irisan pH larutan. Beberapa trayek indikator pada wujud larutan ditunjukkan pada tabel berikut:
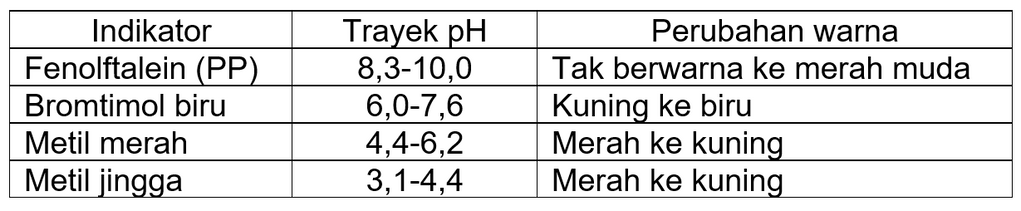
a. Untuk titrasi asam kuat oleh basa kuat, pH meningkat sangat tajam dari pH 4-10 hanya dengan sedikit penambahan larutan basa. Setelah titik ekuivalen, pH berubah amat lambat jika ditambah basa kuat. Indikator-indikator yang perubahan warnanya berada dalam rentang pH titrasi ini antara pH 4 sampai 10. Untuk titrasi asam kuat oleh basa kuat, besarnya pH saat titik ekuivalen adalah 7. Jadi, indikator yang dapat digunakan pada titrasi ini adalah metil merah, bromtimol biru, dan fenolftalein.
b. Untuk titrasi asam lemah oleh basa kuat, pH meningkat tajam dari pH 7-10 hanya dengan sedikit penambahan larutan basa. Pemilihan indikator yang cocok untuk titrasi asam lemah oleh basa kuat lebih terbatas, yaitu indikator yang mempunyai trayek pH antara 7 sampai 10. Maka, indikator yang dipakai adalah fenolftalein.
c. Untuk titrasi basa lemah oleh asam kuat, pH turun sedikit demi sedikit kemudian mengalami penurunan drastis pada pH antara 4-7. Titik ekuivalen terjadi pada pH <7. Oleh sebab itu, indikator yang paling cocok adalah indikator metil merah.
















