Iklan
Pertanyaan
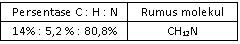
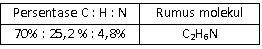
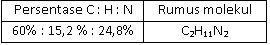
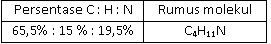
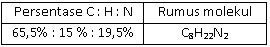
Suatu sampel cairan yang berbau amis seberat 0,2 gram yang diketahui mengandung karbon, hidrogen, dan nitrogen dibakar dan menghasilkan 0,482 g CO 2 dan 0,271 g H 2 O . Sampel kedua dengan berat 0,25 g direaksikan sedemikian rupa sehingga semua nitrogennya berubah menjadi gas N 2 .Gas ini dikumpulkan ternyata volumenya 42,3 ml pada 26 , 5 ∘ C dan tekanannya 755 torr. Jika diketahui A r C = 12, O= 16, H = 1, N = 14, maka persentase karbon, hidrogen, dan nitrogen dalam senyawa ini, serta rumus molekul yang tepat adalah ....
Suatu sampel cairan yang berbau amis seberat 0,2 gram yang diketahui mengandung karbon, hidrogen, dan nitrogen dibakar dan menghasilkan 0,482 g dan 0,271 g . Sampel kedua dengan berat 0,25 g direaksikan sedemikian rupa sehingga semua nitrogennya berubah menjadi gas . Gas ini dikumpulkan ternyata volumenya 42,3 ml pada dan tekanannya 755 torr. Jika diketahui C = 12, O = 16, H = 1, N = 14, maka persentase karbon, hidrogen, dan nitrogen dalam senyawa ini, serta rumus molekul yang tepat adalah ....
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
1
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia