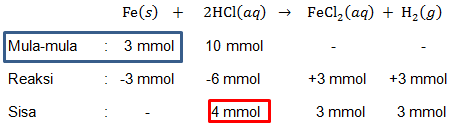Iklan
Pertanyaan
Suatu contoh cuplikan yang mengandung logam besi bermassa 2 gram, direaksikan dengan 100 mL larutan asam klorida 0,100 M. Kelebihan asam klorida dititrasi dengan KOH 0,125 M dan menghabiskan KOH sebanyak 32 mL. tentukan kadar besi dalam cuplikan tersebut jika A r Fe = 56 dan reaksi yang terjadi: Fe ( s ) + 2 HCl ( a q ) → FeCl 2 ( a q ) + H 2 ( g )
Suatu contoh cuplikan yang mengandung logam besi bermassa 2 gram, direaksikan dengan 100 mL larutan asam klorida 0,100 M. Kelebihan asam klorida dititrasi dengan KOH 0,125 M dan menghabiskan KOH sebanyak 32 mL. tentukan kadar besi dalam cuplikan tersebut jika dan reaksi yang terjadi:
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
1
5.0 (15 rating)
AD
Aditya Dimas
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia