Iklan
Pertanyaan
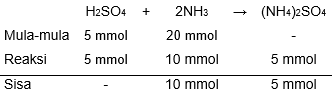
Soal terdiri atas 3 bagian, yaitu PERNYATAAN; kata SEBAB; dan ALASAN yang disusun berurutan. Campuran 50 mL larutan H 2 SO 4 0,1 M dan 100 mL larutan NH 3 0,2 M membentuk larutan dengan pH 9 ( K b = 1 0 − 5 ) . SEBAB Asam konjugasi yang terbentuk adalah NH 4 + . Pernyataan yang tepat tentang kedua kalimat di atas adalah ...
Soal terdiri atas 3 bagian, yaitu PERNYATAAN; kata SEBAB; dan ALASAN yang disusun berurutan.
Campuran 50 mL larutan 0,1 M dan 100 mL larutan 0,2 M membentuk larutan dengan pH 9 .
SEBAB
Asam konjugasi yang terbentuk adalah .
Pernyataan yang tepat tentang kedua kalimat di atas adalah ...
Pernyataan benar, alasan benar, dan keduanya menunjukkan hubungan sebab dan akibat.
Pernyataan benar, alasan benar, tetapi keduanya tidak menunjukkan hubungan sebab dan akibat.
Pernyataan benar dan alasan salah.
Pernyataan salah dan alasan benar.
Pernyataan dan alasan salah.
Iklan
S. Lubis
Master Teacher
9
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia