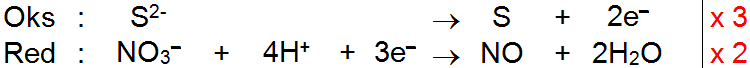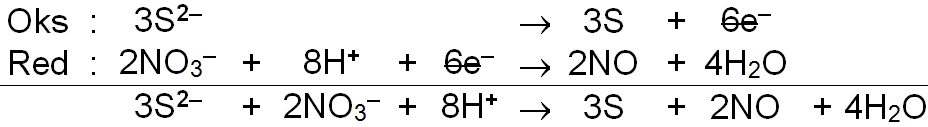Iklan
Pertanyaan
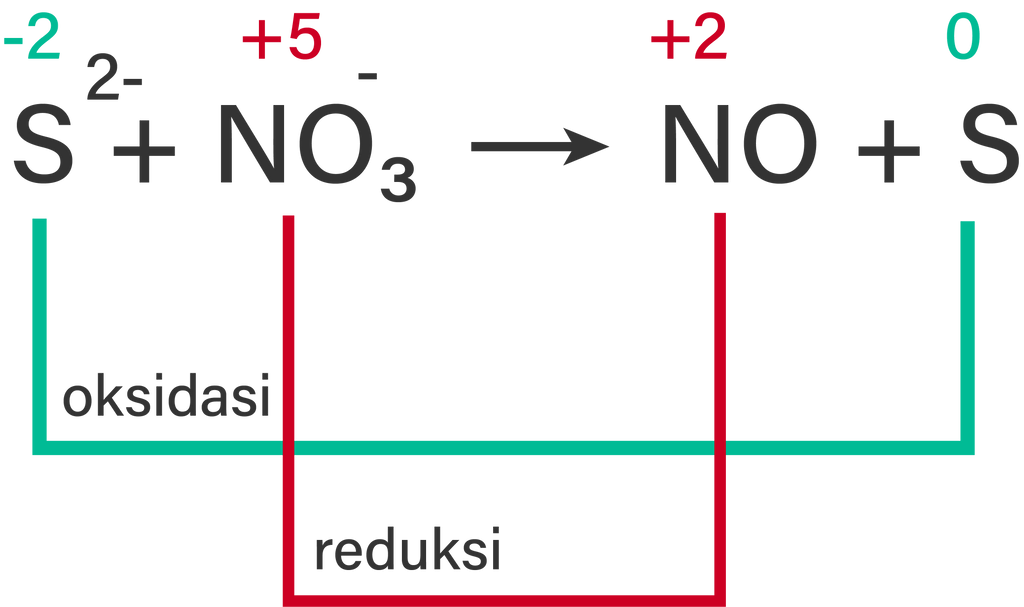
Setarakan reaksi redoks berikut dengan menggunakan metode setengah reaksi! b. S 2 − ( a q ) + NO 3 − ( a q ) → NO ( a q ) + S ( s ) (Suasana asam)
Setarakan reaksi redoks berikut dengan menggunakan metode setengah reaksi!
b. (Suasana asam)
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
17
4.4 (19 rating)
AA
Aisyiatul Aqila
Makasih ❤️
JS
Jiwo Samudro
Pembahasan lengkap banget
tz
teryn z
Makasih
fd
febry degez
Ini yang aku cari!
N
Nurdiana
Pembahasan tidak lengkap Pembahasan tidak menjawab soal
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia