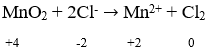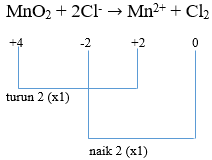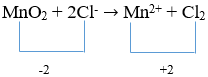Reaksi redoks merupakan reaksi yang melibatkan perubahan bilangan oksidasi. Reaksi redoks merupakan gabung dari reaksi oksidasi dan reaksi reduksi.
Untuk menyetarakan reaksi redos tersebut dalam suasana asam terdapat 2 cara yaitu:
1. Metode Biloks
Metode biloks terdapat beberapa langkah yaitu:
- Menentukan unsur yang mengalami perubahan bilangan oksidasi dan menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi
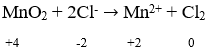
- Menentukan naik turun biloks
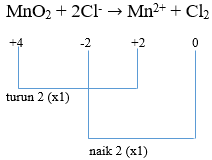
- Menyetarakan jumlah muatan dengan menambahkan H+
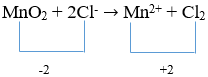
4H++MnO2+2Cl−→Mn2++Cl2
- Menyetarakan jumlah H dengan menambahkan H2O secukupnya
4H++MnO2+2Cl−→Mn2++Cl2+2H2O
2. Metode Setengah Reaksi
Metode setengah reaksi terdiri dari beberapa langkah yaitu:
- Menentukan reaksi reduksi dan reaksi oksidasi
Reduksi: MnO2→Mn2+
Oksidasi: Cl−→Cl2
- Menyetarakan jumlah atom selain O dan H
Reduksi: MnO2→Mn2+
Oksidasi: 2Cl−→Cl2
- Menyetarakan jumlah atom O dan H
Menyetarakan atom O dengan menambahkan H2O pada ruas dengan jumlah O yang kurang (tidak ada)
Menyetarakan atom H dengan menambahkan H+
Reduksi: 4H++MnO2→Mn2++2H2O
Oksidasi: 2Cl−→Cl2
- Menyetarakan muatan dan dijumlahkan
Reduksi: 2e−+4H++MnO2→Mn2++2H2O
Oksidasi: 2Cl−→Cl2+2e−
Kedua reaksi tersebut memiliki muatan e− yang sama.
4H++MnO2+2Cl−→Mn2++Cl2+2H2O
Jadi, jawaban yang benar sesuai dengan uraian di atas.