Iklan
Pertanyaan
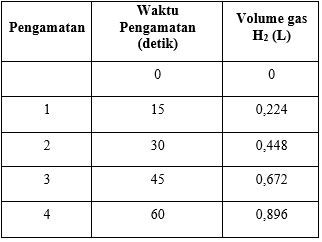
Seorang siswa mereaksikan sejumlah logam magnesium dengan 2 L asam fosfat menghasilkan gas hidrogen sesuai reaksi berikut. Mg ( s ) + H 3 PO 4 ( a q ) → Mg 3 ( PO 4 ) 2 ( a q ) + H 2 ( g ) Gas yang dihasilkan ditampung dan diukur setiap 15 detik pada kondisi STP kemudiandidapatkan data sebagai berikut. Berdasarkan data di atas,laju pengurangan dari asam fosfat sebesar ....
Seorang siswa mereaksikan sejumlah logam magnesium dengan 2 L asam fosfat menghasilkan gas hidrogen sesuai reaksi berikut.
Gas yang dihasilkan ditampung dan diukur setiap 15 detik pada kondisi STP kemudian didapatkan data sebagai berikut.
Berdasarkan data di atas, laju pengurangan dari asam fosfat sebesar ....
Iklan
MR
M. Robo
Master Teacher
Jawaban terverifikasi
5
3.0 (1 rating)
HA
Himmatul Aulia
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia