Iklan
Pertanyaan
Seorang praktikan mereaksikan sejumlah logam kalsium dengan 1 L asam kloridamenghasilkan gas hidrogen sesuai persamaan reaksi berikut. Ca ( s ) + HCl ( a q ) → CaCl 2 ( a q ) + H 2 ( g ) Kemudian, praktikan menampung gas yang dihasilkan dan mengukurnya tiap 10 detik pada kondisi STP, lalu didapatkan data sebagai berikut. Dari data tersebut, laju pengurangan dari asam klorida adalah ....
Seorang praktikan mereaksikan sejumlah logam kalsium dengan 1 L asam klorida menghasilkan gas hidrogen sesuai persamaan reaksi berikut.
Kemudian, praktikan menampung gas yang dihasilkan dan mengukurnya tiap 10 detik pada kondisi STP, lalu didapatkan data sebagai berikut.
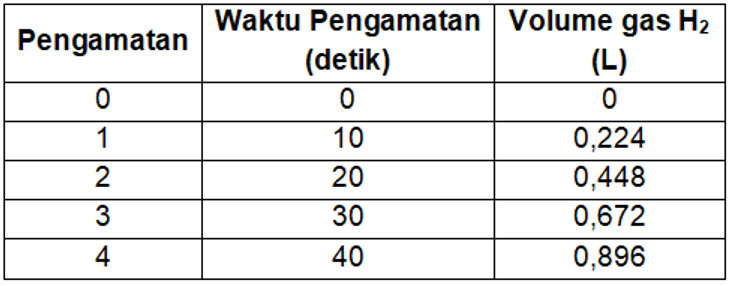
Dari data tersebut, laju pengurangan dari asam klorida adalah ....
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
5
5.0 (1 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















