Iklan
Pertanyaan
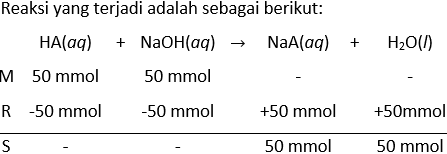
Seorang siswa diberi larutan asam lemah monoprotik, HA, 1,00 M sebanyak 50,0 mL. Larutan ini dititrasi dengan IarutanNaOH 1,250 M sampai titik akhir membentuk larutan X. (Anggaplah bahwa titik akhir pada titik ekuivalen). a.Jelaskan mengapa larutan bersifat basa pada titik ekivalen, dengan menyetiakan persamaan reaksinya. Siswa diberi larutan sampel yang lain, yaitu larutan HA 1,00 M sebanyak 50,0 mL, yang siswa tambahkan ke dalam larutan X. Larutan yang dihasilkan memiliki pH 5,00. b.Berapakah nilai tetapan ionisasi asam ( K a ) untuk asam lemah ini? c.Jelaskan mengapa penambahan beberapa tetes NaOH 1,250 M pada larutan yang diperoleh tidak mengubah pH larutan secara signifikan?
Seorang siswa diberi larutan asam lemah monoprotik, HA, 1,00 M sebanyak 50,0 mL. Larutan ini dititrasi dengan Iarutan NaOH 1,250 M sampai titik akhir membentuk larutan X. (Anggaplah bahwa titik akhir pada titik ekuivalen).
a. Jelaskan mengapa larutan bersifat basa pada titik ekivalen, dengan menyetiakan persamaan reaksinya.
Siswa diberi larutan sampel yang lain, yaitu larutan HA 1,00 M sebanyak 50,0 mL, yang siswa tambahkan ke dalam larutan X. Larutan yang dihasilkan memiliki pH 5,00.
b. Berapakah nilai tetapan ionisasi asam untuk asam lemah ini?
c. Jelaskan mengapa penambahan beberapa tetes NaOH 1,250 M pada larutan yang diperoleh tidak mengubah pH larutan secara signifikan?
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
6
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia