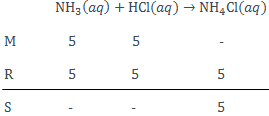Iklan
Iklan
Pertanyaan
Sebanyak 25 mL larutan HCl 0 , 2 M direaksikan dengan 25 mL NH 3 0 , 2 M sesuai reaksi: NH 3 ( a q ) + HCl ( a q ) → NH 4 Cl ( a q ) Hitung harga pH larutan yang terbentuk! ( K b NH 3 = 1 0 − 5 ) .
Sebanyak larutan direaksikan dengan sesuai reaksi:
Hitung harga pH larutan yang terbentuk! .
Iklan
SO
S. Oktasari
Master Teacher
Mahasiswa/Alumni Universitas Padjadjaran
Jawaban terverifikasi
21
4.9 (10 rating)
AW
Anggita Wijayanti
Makasih ❤️
SA
Syafira Aulia Fitri
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia