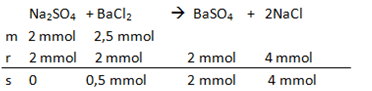Iklan
Pertanyaan
Sebanyak 50 mL larutan Na 2 SO 4 0,04 M ditambahkan ke dalam 50 mL larutan BaCl 2 0,05 M. Jika K sp BaSO 4 1 , 0 × 1 0 − 10 , pernyataan berikut yang benar adalah ... Larutan sebagai pereaksi pembatas. Konsentrasi Ba 2 + sisa di dalam larutan sebanyak 0,01 M. Kelarutan BaSO 4 dalam air murni adalah 1 0 − 5 M. Dalam larutan tidak terbentuk endapan .
Sebanyak 50 mL larutan 0,04 M ditambahkan ke dalam 50 mL larutan 0,05 M. Jika , pernyataan berikut yang benar adalah ...
- Larutan
sebagai pereaksi pembatas.
- Konsentrasi sisa di dalam larutan sebanyak 0,01 M.
- Kelarutan dalam air murni adalah M.
- Dalam larutan tidak terbentuk endapan
.
1, 2, dan 3 SAJA yang benar.
1 dan 3 SAJA yang benar.
2 dan 4 SAJA yang benar.
HANYA 4 yang benar.
SEMUA pilihan benar.
Iklan
SL
S. Lubis
Master Teacher
Jawaban terverifikasi
3
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia