Reaksi pada titrasi asam basa merupakan reaksi netralisasi. Dalam soal, diketahui asam kuat  (titrat) dititrasi dengan basa kuat
(titrat) dititrasi dengan basa kuat  (titran). Sebelum titik ekivalen tercapai, maka akan terjadi kelebihan asam kuat, sehingga pH akan dibawah 7. Saat titik ekivalen tercapai, dimana mol
(titran). Sebelum titik ekivalen tercapai, maka akan terjadi kelebihan asam kuat, sehingga pH akan dibawah 7. Saat titik ekivalen tercapai, dimana mol  sama dengan mol
sama dengan mol  , akan diperoleh pH 7. Saat titik ekivalen dilewati, maka diperoleh pH di atas 7 karena adanya kelebihan mol basa.
, akan diperoleh pH 7. Saat titik ekivalen dilewati, maka diperoleh pH di atas 7 karena adanya kelebihan mol basa.
a. pH Larutan
pH larutan pada pembahasan ini akan diambil 5 titik yang representatif, yaitu pada penambahan volume  sebanyak 0, 25, 50, 75 dan 100 mL
sebanyak 0, 25, 50, 75 dan 100 mL
pH saat penambahan 0 mL 
Saat ditambah  0 mL, artinya dalam larutan hanya ada asam, sehingga pHnya bisa langsung dihitung
0 mL, artinya dalam larutan hanya ada asam, sehingga pHnya bisa langsung dihitung

pH saat penambahan 25 mL 
Saat ditambah  25 mL, konsentrasi
25 mL, konsentrasi  dalam larutan akan berkurang karena adanya ion
dalam larutan akan berkurang karena adanya ion  . pH dapat dihitung dari konsentrasi
. pH dapat dihitung dari konsentrasi  yang tersisa dalam larutan
yang tersisa dalam larutan

pH saat penambahan 50 mL 
Saat penambahan 50 mL  , maka akan tercapai titik ekivalen. Hal ini terjadi karena mol asam kuat dan basa kuat jumlahnya sama. pH pada titik ekivalen adalah 7.
, maka akan tercapai titik ekivalen. Hal ini terjadi karena mol asam kuat dan basa kuat jumlahnya sama. pH pada titik ekivalen adalah 7.

pH saat penambahan 75 mL 
Saat penambahan 75 mL  , akan terjadi kelebihan mol
, akan terjadi kelebihan mol  , sehingga pH larutan akan lebih dari 7. Saat penambahan NaOH berlebih, maka akan tersisa ion
, sehingga pH larutan akan lebih dari 7. Saat penambahan NaOH berlebih, maka akan tersisa ion  dalam larutan, sehingga harus mencari nilai pOH untuk mengetahui nilai pH
dalam larutan, sehingga harus mencari nilai pOH untuk mengetahui nilai pH

pH saat penambahan 100 mL 
Saat penambahan 100 mL  , akan terjadi kelebihan mol
, akan terjadi kelebihan mol  , sehingga pH larutan akan lebih dari 7. Saat penambahan NaOH berlebih, maka akan tersisa ion
, sehingga pH larutan akan lebih dari 7. Saat penambahan NaOH berlebih, maka akan tersisa ion  dalam larutan, sehingga harus mencari nilai pOH untuk mengetahui nilai pH
dalam larutan, sehingga harus mencari nilai pOH untuk mengetahui nilai pH

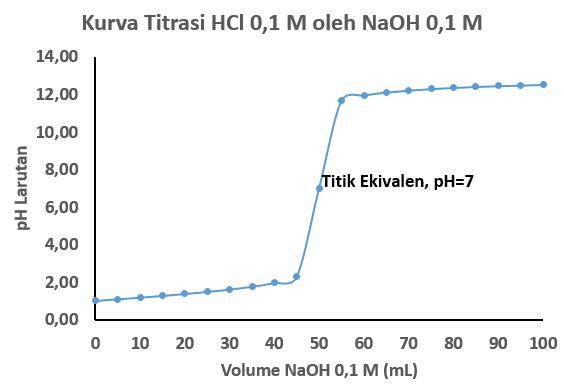
b. Kurva titrasi  0,1 M oleh
0,1 M oleh  0,1 M
0,1 M
Kurva titrasi dapat dibuat dengan plot sumbu x berupa volume  dan sumbu y berupa pH larutan
dan sumbu y berupa pH larutan