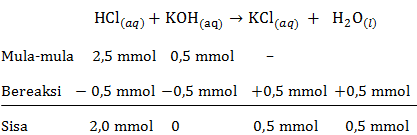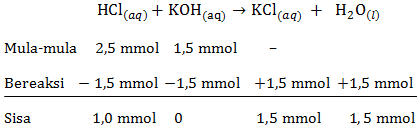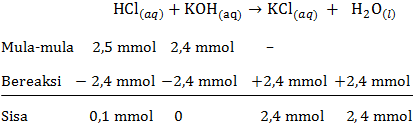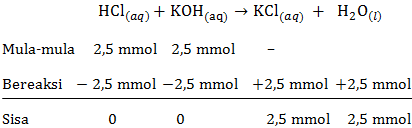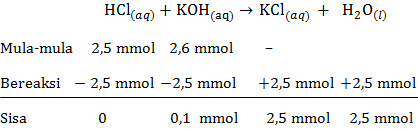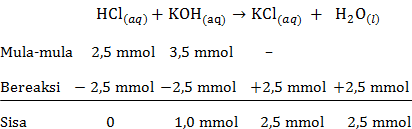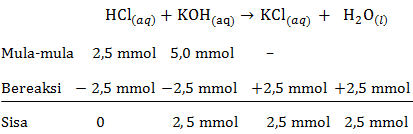HCl merupakan asam kuat dan KOH merupakan basa kuat. Untuk menentukan pH larutan dari titrasi larutan HCl dan larutan KOH, dengan cara sebagai berikut :
a. pH HCl sebelum ditambah KOH
[H+]=M×a[H+]=0,1×1=10−1M pH=−log[H+] pH=−log10−1 pH=1
Jadi, pH larutan HCl sebelum ditambahkan KOH adalah 1.
b. pH larutan HCl setelah ditambah KOH sebanyak 5 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×5mol KOH=0,5 mmol
Persamaan reaksi asam-basa:
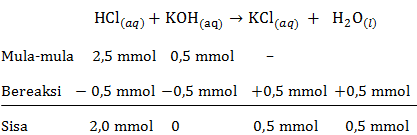
Pada reaksi asam-basa tersebut HCl memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH asam kuat sebagai berikut:
[H+]=M×a[H+]=V totaln×1[H+]=30 mL2 mmol×1[H+]=6,7×10−2 MpH=−log[H+]pH=−log(6,7×10−2)pH=2−log 6,7=1,17
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 5 mL adalah 1,17.
c. pH larutan HCl setelah ditambah KOH sebanyak 15 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×15mol KOH=0,5 mmol
Persamaan reaksi asam-basa:
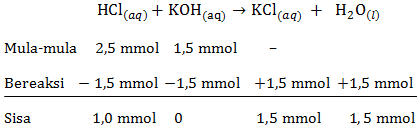
Pada reaksi asam-basa tersebut HCl memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH asam kuat sebagai berikut:
[H+]=M×a[H+]=V totaln×1[H+]=40 mL1 mmol×1[H+]=2,5×10−2 MpH=−log[H+]pH=−log(2,5×10−2)pH=2−log2,5=1,60
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 15 mL adalah 1,60.
d. pH larutan HCl setelah ditambah KOH sebanyak 24 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×24mol KOH=2,4 mmol
Persamaan reaksi asam-basa:
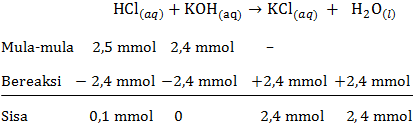
Pada reaksi asam-basa tersebut HCl memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH asam kuat sebagai berikut:
[H+]=M×a[H+]=V totaln×1[H+]=49 mL0,1 mmol×1[H+]=2×10−3 MpH=−log[H+]pH=−log(2×10−3)pH=3−log2=2,70
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 24 mL adalah 2,70.
e. pH larutan HCl setelah ditambah KOH sebanyak 25 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×25mol KOH=2,5 mmol
Persamaan reaksi asam-basa:
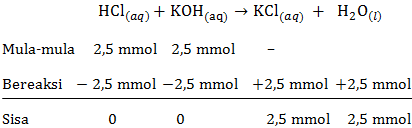
Pada saat titik ekuivalen, larutan bersifat netral karena baik asam maupun basa sudah habis bereaksi maka pH yang terbentuk = 7.
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 25 mL adalah 7.
f) pH larutan HCl setelah ditambah KOH sebanyak 26 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×26mol KOH=2,6 mmol
Persamaan reaksi asam-basa:
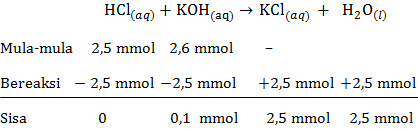
Pada reaksi asam-basa tersebut KOH memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH basa kuat sebagai berikut:
[OH−]=M×b[OH−]=V totaln×1[OH−]=510,1×1[OH−]=2×10−3 MpOH=−log[OH−]pOH=−log(2×10−3)pOH=3−log2=2,70pH=14−pOHpH=14−2,70pH=11,30
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 26 mL adalah 11,30.
g. pH larutan HCl setelah ditambah KOH sebanyak 35 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×35mol KOH=3,5 mmol
Persamaan reaksi asam-basa:
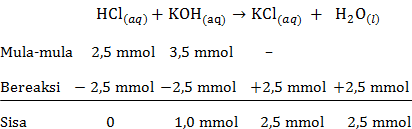
Pada reaksi asam-basa tersebut KOH memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH basa kuat sebagai berikut:
[OH−]=M×b[OH−]=V totaln×1[OH−]=60 mL1 mmol×1[OH−]=1,67×10−2 MpOH=−log[OH−]pOH=−log(1,67×10−2)pOH=2−log1,67=1,78pH=14−pOHpH=14−1,78pH=12,22
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 35 mL adalah 12,22.
h. pH larutan HCl setelah ditambah KOH sebanyak 50 mL
mol HCl=M×Vmol HCl=0,1×25mol HCl=2,5 mmolmol KOH=M×Vmol KOH=0,1×50mol KOH=5 mmol
Persamaan reaksi asam-basa:
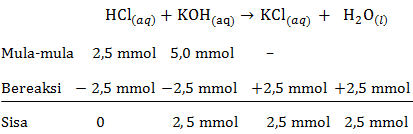
Pada reaksi asam-basa tersebut KOH memiliki sisa yang belum bereaksi, maka rumus untuk menentukan pH menggunakan pH basa kuat sebagai berikut:
[OH−]=M×b[OH−]=V totaln×1[OH−]=75 mL2,5 mmol×1[OH−]=3,3×10−2 MpOH=−log[OH−]pOH=−log(3,3×10−2)pOH=2−log3,3=1,48pH=14−pOHpH=14−1,48pH=12,52
Jadi, pH larutan HCl setelah ditambah KOH sebanyak 50 mL adalah 12,52.
Data titrasi 25 mL larutan HCl 0,1 M dengan larutan KOH 0,1 M berbagai volume:
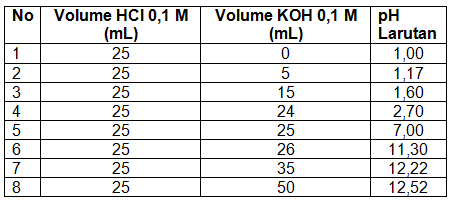
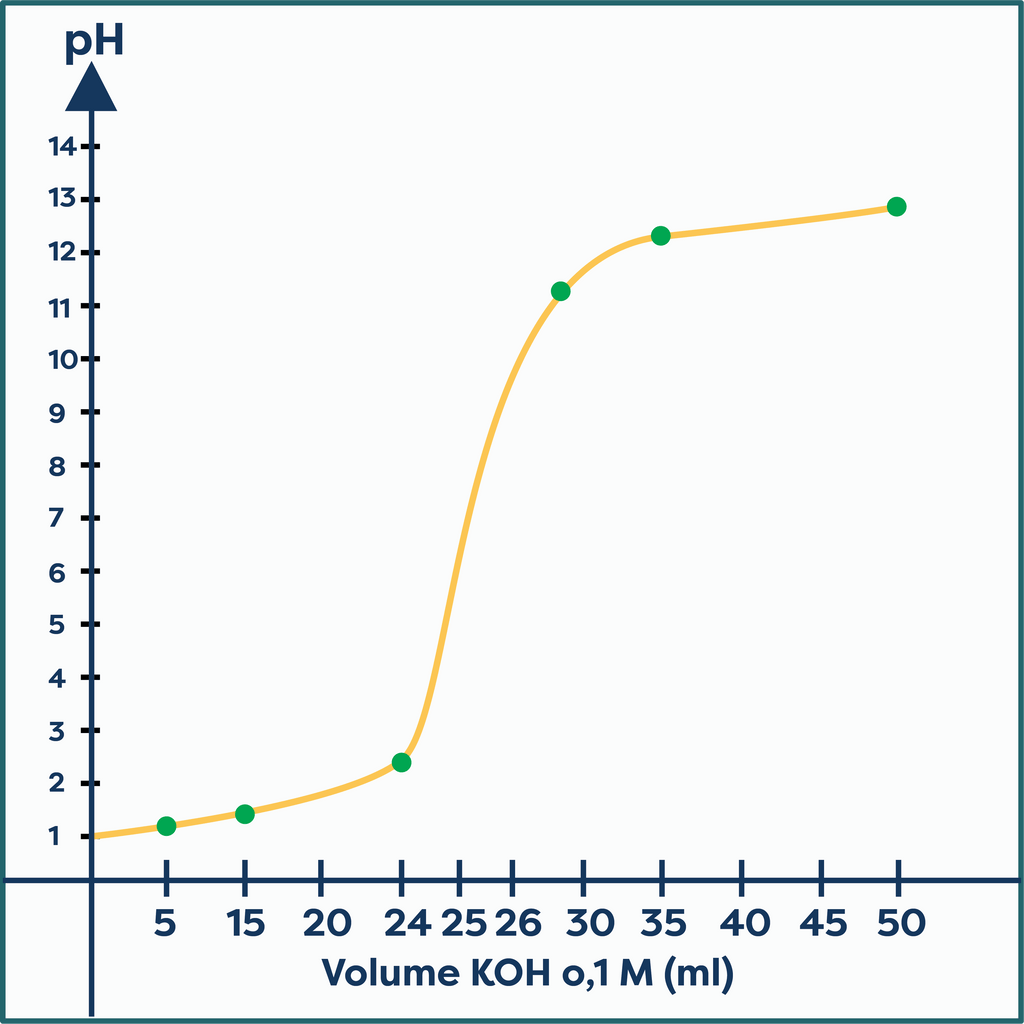
Jadi, kurva titrasi adalah seperti gambar tersebut.