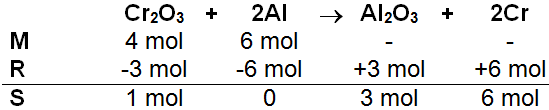Di dalam suatu reaksi kimia, perbandingan mol zat-zat pereaksi yang ditambahkan tidak selalu sama dengan perbandingan koefisien reaksinya. Hal ini menyebabkan ada zat pereaksi yang akan habis bereaksi lebih dahulu. Pereaksi ini disebut sebagai pereaksi pembatas.
Langkah-langkah penyelesaian soal di atas adalah sebagai berikut:
a. Persamaan reaksi disetarakan dengan cara berikut:
- Memperhatikan jumlah setiap atom pada ruas kiri dan kanan pada persamaan reaksi. Pada persamaan reaksi:
 jumlah setiap atom yang terlibat reaksi adalah seperti pada tabel di bawah ini.
jumlah setiap atom yang terlibat reaksi adalah seperti pada tabel di bawah ini.

- Jumlah atom Cr di ruas kiri adalah 2, sementara jumlah atom Cr di ruas kanan adalah 1, maka ditambahkan koefisien 2 di depan atom Cr ruas kanan, sehingga jumlah atom Cr di ruas kanan menjadi 2 buah atom Cr (setara dengan jumlah Cr di ruas kiri).

- Jumlah atom Al di ruas kiri adalah 1, sementara jumlah atom Al di ruas kanan adalah 2, maka ditambahkan koefisien 2 di depan atom Al ruas kiri, sehingga jumlah atom Al di ruas kiri menjadi 2 buah atom Al (setara dengan jumlah Al di ruas kanan).

- Jumlah atom O di ruas kiri = 3, dan jumlah atom O di ruas kanan juga = 3, maka jumlah atom O telah sama (setara).

- Menuliskan persamaan reaksi setaranya sebagai berikut:


b. Mol masing-masing zat dibagi dengan koefisien pada persamaan reaksinya, kemudian dipilih hasil bagi yang terkecil merupakan pereaksi pembatas.

Karena hasil bagi mol Al < mol  , maka Al adalah pereaksi pembatas, sehingga mol Al akan habis bereaksi lebih dahulu.
, maka Al adalah pereaksi pembatas, sehingga mol Al akan habis bereaksi lebih dahulu.
c. Selanjutnya mol zat-zat pereaksi dimasukkan ke dalam persamaan reaksi M (mula-mula), R (reaksi) dan S (sisa), serta mol zat lain yang bereaksi dapat dihitung dari perbandingan koefisien dengan Al sebagai pereaksi pembatas seperti persamaan berikut:
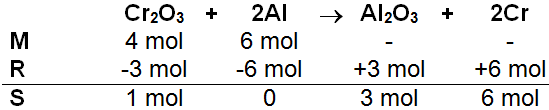
Berdasarkan persamaan reaksi di atas, diketahui terbentuk 3 mol senyawa  . Massa dan
. Massa dan  senyawa
senyawa  adalah sebagai berikut.
adalah sebagai berikut.

Jadi, persamaan reaksi yang setara adalah  , pereaksi pembatas adalah Al, dan
, pereaksi pembatas adalah Al, dan  senyawa
senyawa  adalah 102 g/mol, serta massa
adalah 102 g/mol, serta massa  yang terbentuk adalah 306 gram.
yang terbentuk adalah 306 gram.