Iklan
Pertanyaan
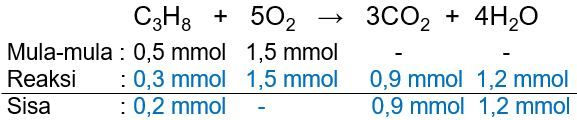
Sebanyak 22 gram C 3 H 8 direaksikan dengan 48 gram O 2 berdasarkan persamaan reaksi berikut. C 3 H 8 + O 2 → CO 2 + H 2 O Tentukan zat yang merupakan pereaksi pembatas dan massa zat yang tersisa! (Ar C = 12, H = 1, O = 16)
Sebanyak 22 gram C3H8 direaksikan dengan 48 gram O2 berdasarkan persamaan reaksi berikut.
Tentukan zat yang merupakan pereaksi pembatas dan massa zat yang tersisa! (Ar C = 12, H = 1, O = 16)
Iklan
IY
I. Yassa
Master Teacher
Jawaban terverifikasi
40
4.7 (4 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia