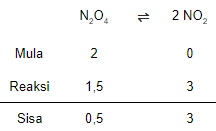Iklan
Pertanyaan
Sebanyak 2 mol gas N 2 O 4 dipanaskan dalam suatu ruangan sehingga 75% terdisosiasi membentuk gas NO 2 dengan reaksi sebagai berikut: N 2 O 4 ( g ) ⇄ 2 NO 2 ( g ) Jika diketahui tekanan total campuran adalah 8 atm, Tentukan harga K p pada suhu tersebut!
Sebanyak 2 mol gas dipanaskan dalam suatu ruangan sehingga 75% terdisosiasi membentuk gas dengan reaksi sebagai berikut:
Jika diketahui tekanan total campuran adalah 8 atm, Tentukan harga pada suhu tersebut!
Iklan
IY
I. Yassa
Master Teacher
Jawaban terverifikasi
18
4.5 (7 rating)
CZ
Cindy Zenada
Pembahasan lengkap banget
A
Asmaulia
Ini yang aku cari!
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia