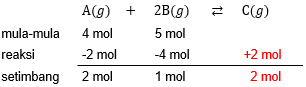Iklan
Pertanyaan
Dalam ruang 1 liter dicampur 4 mol zat A dan 5 mol zat B. Reaksi kesetimbangan: A ( g ) + 2 B ( g ) ⇄ C ( g ) Jika pada saat setimbang diperoleh 2 mol C dan tekanan total 10 atm, maka besarnya K p adalah ....
Dalam ruang 1 liter dicampur 4 mol zat A dan 5 mol zat B. Reaksi kesetimbangan:
Jika pada saat setimbang diperoleh 2 mol C dan tekanan total 10 atm, maka besarnya adalah ....
0,05
0,25
0,50
0,60
0,80
Iklan
DV
D. Vitama
Master Teacher
Mahasiswa/Alumni Universitas Islam Negeri Sunan Kalijaga
Jawaban terverifikasi
34
4.5 (14 rating)
Na
Nida20 azizah
Mudah dimengerti Ini yang aku cari! Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia