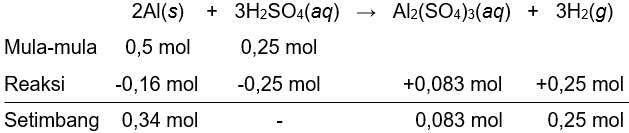Iklan
Pertanyaan
Sebanyak 13,5 gram logam aluminium dengan 24,5 gram asamsulfat sesuai dengan reaksi: 2 AI ( s ) + 3 H 2 SO 4 ( a q ) → AI 2 ( SO 4 ) 3 ( a q ) + 3 H 2 ( g ) Tentukan: a. massa pereaksi yang tersisa, b. massa garam yang terbentuk, dan c. volume gas yang dihasilkan pada keadaan RTP.
Sebanyak 13,5 gram logam aluminium dengan 24,5 gram asam sulfat sesuai dengan reaksi:
Tentukan:
a. massa pereaksi yang tersisa,
b. massa garam yang terbentuk, dan
c. volume gas yang dihasilkan pada keadaan RTP.
Iklan
IS
I. Solichah
Master Teacher
Jawaban terverifikasi
1
5.0 (3 rating)
AC
Alfredo Calvin
Mudah dimengerti Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia