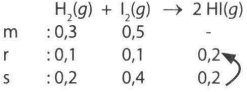Iklan
Pertanyaan
Sebanyak 0,3atm gas hidrogen dan 0,5 atm gas I 2 bereaksi pada kondisi tertentu sehingga pada saat kesetimbangan tercapai diperoleh tekanan gas HI sebesar 0,2 atm. Pada kondisi tersebut, harga K c adalah 0,5. SEBAB Untuk reaksi kesetimbangan tersebut harga K c = K p . Pernyataan yang tepat tentang kedua kalimat di atas adalah ....
Sebanyak 0,3 atm gas hidrogen dan 0,5 atm gas bereaksi pada kondisi tertentu sehingga pada saat kesetimbangan tercapai diperoleh tekanan gas sebesar 0,2 atm. Pada kondisi tersebut, harga adalah 0,5.
SEBAB
Untuk reaksi kesetimbangan tersebut harga .
Pernyataan yang tepat tentang kedua kalimat di atas adalah ....
Pernyataan benar, alasan benar, dan keduanya menunjukkan hubungan sebab dan akibat.
Pernyataan benar, alasan benar, tetapi keduanya tidak menunjukkan hubungan sebab dan akibat.
Pernyataan benar dan alasan salah
Pernyataan salah dan alasan benar.
Pernyataan dan alasan salah.
Iklan
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
1
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia