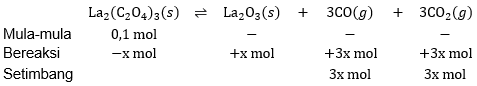Iklan
Pertanyaan
Sebanyak 0,1 mol lantanium oksalat La 2 ( C 2 O 4 ) 3 diletakkan dalam ruang hampa 10 liter dan dibiarkan terurai hingga mencapai kesetimbangan pada suhu tetap seperti berikut. La 2 ( C 2 O 4 ) 3 ( s ) ⇌ La 2 O 3 ( s ) + 3 CO ( g ) + 3 CO 2 ( g ) Jika dalam keadaan setimbang tekanan total dalam ruangan tersebut 0,2 atm, harga K p untuk reaksi diatas adalah ....
Sebanyak 0,1 mol lantanium oksalat diletakkan dalam ruang hampa 10 liter dan dibiarkan terurai hingga mencapai kesetimbangan pada suhu tetap seperti berikut.
Jika dalam keadaan setimbang tekanan total dalam ruangan tersebut 0,2 atm, harga untuk reaksi di atas adalah ....
Iklan
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
4
4.5 (11 rating)
PP
Pretty Perianda Syafrika
Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia