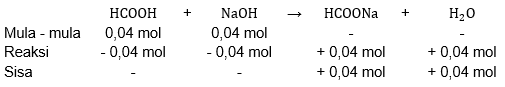Pertanyaan
Satu liter larutan asam asetat HCOOH 0,04 M ditambahkan 1,6 gram NaOH ( A r :Na = 23, O = 16, H = 1). Hitunglah pH larutan campurannya!
Satu liter larutan asam asetat HCOOH 0,04 M ditambahkan 1,6 gram NaOH (: Na = 23, O = 16, H = 1). Hitunglah pH larutan campurannya!


Belajar bareng Champions
Brain Academy Champions
Hanya di Brain Academy
Habis dalam
00
:
00
:
03
:
24
NP
N. Puspita
Master Teacher
Jawaban terverifikasi
6
5.0 (1 rating)
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia