Iklan
Pertanyaan
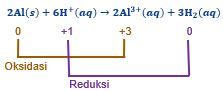
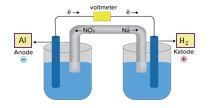
Reaksi redoks berikut berlangsung spontan. 2 Al ( s ) + 6 H + ( a q ) → 2 Al 3 + ( a q ) + 3 H 2 ( a q ) Gambarkan rangkaian sel Volta yang berdasarkan reaksi tersebut. Tuliskan juga diagram (notasi) sel Volta tersebut.
Reaksi redoks berikut berlangsung spontan.
Gambarkan rangkaian sel Volta yang berdasarkan reaksi tersebut. Tuliskan juga diagram (notasi) sel Volta tersebut.
Iklan
N. Puspita
Master Teacher
8
4.9 (17 rating)
Sin Hyung
Pembahasan lengkap banget
celine rawles
Pembahasan lengkap banget
Satriyo wibisono
Mudah dimengerti Makasih ❤️
MAHARANi
Ini yang aku cari! Pembahasan lengkap banget Mudah dimengerti Bantu banget Makasih ❤️
Alya Widya Ananta
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia