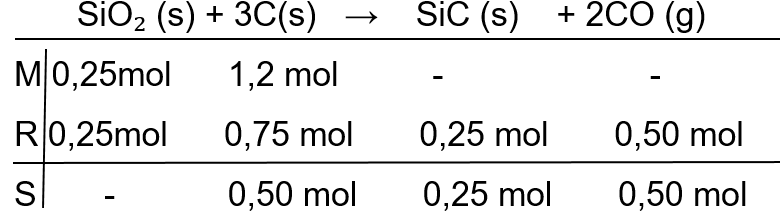Iklan
Pertanyaan
Reaksi antara silikon dioksida dengan karbon berlangsung dengan cara pemanasan menurut reaksi (belum setara) berikut. SiO 2 ( s ) + C ( s ) → SiC ( s ) + CO ( g ) Jika 15g SiO 2 direaksikan dengan 15g karbon maka massa gas CO (A r : Si = 28; C= 12; O = 16) yang diperoleh adalah ...
Reaksi antara silikon dioksida dengan karbon berlangsung dengan cara pemanasan menurut reaksi (belum setara) berikut.
Jika 15g SiO2 direaksikan dengan 15g karbon maka massa gas CO (Ar : Si = 28; C= 12; O = 16) yang diperoleh adalah ...
9,5 g
14g
38 g
40 g
47,5 g
Iklan
AN
A. Nurul
Master Teacher
Mahasiswa/Alumni UIN Syarif Hidayatullah Jakarta
Jawaban terverifikasi
17
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia