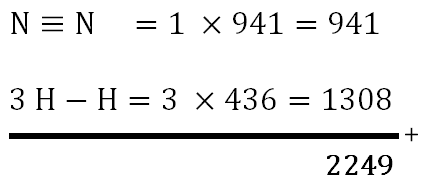Iklan
Iklan
Pertanyaan
Persamaan reaksi gas N 2 dan gas H 2 sebagai berikut. N 2 ( g ) + 3 H 2 ( g ) → 2 NH 3 ( g ) △ H = − 97 kJ Jika energi ikatan H − H dan N ≡ N berturut-turut adalah +436 kJ/mol dan +941 kJ/mol, energi ikatan rata-rata N − H dalam NH 3 adalah ....
Persamaan reaksi gas dan gas sebagai berikut.
Jika energi ikatan dan berturut-turut adalah +436 kJ/mol dan +941 kJ/mol, energi ikatan rata-rata dalam adalah ....
97 kJ/mol
173 kJ/mol
285 kJ/mol
323 kJ/mol
391 kJ/mol
Iklan
YR
Y. Rochmawatie
Master Teacher
Jawaban terverifikasi
3
4.0 (5 rating)
CG
Carolin Gading
Jawaban tidak sesuai
Iklan
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2024 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia