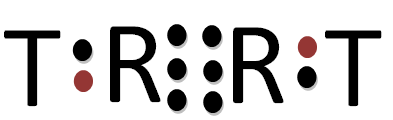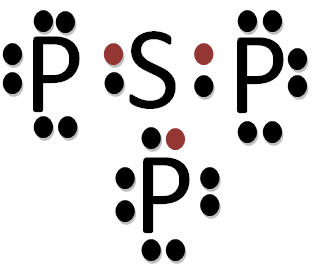Pada kaidah oktet disebutkan bahwa atom-atom cenderung berikatan satu sama lain untuk memiliki konfigurasi elektron seperti gas mulia yaitu terdapat 8 elektron pada kulit terluar atom. Untuk menentukan jumlah elektron terluar atom-atom dalam berikatan maka dibuat konfigurasi elektron masing-masing atom.
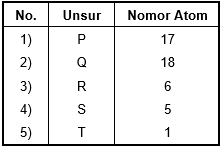
1. 
Unsur P memiliki 7 elektron terluar dan akan menerima 1 elektron untuk berikatan dengan unsur lain.
2. 
Unsur Q memiliki 8 elektron terluar dan sudah sesuai dengan kaidah oktet. Unsur Q kemungkinan besar termasuk gas mulia sudah stabil dan sulit berikatan dengan unsur lain.
3. 
Unsur R memiliki 4 elektron terluar dan akan menerima 4 elektron dari unsur lain untuk berikatan
4. 
Unsur S memiliki 3 elektron terluar dan akan melepaskan 3 elektron tersebut untuk berikatan dengan unsur lain.
5. 
Unsur T memiliki 1 elektron terluar dan akan melepaskan 1 elektron atau menerima 1 elektron untuk berikatan dengan unsur lain.
Struktur dari senyawa
A. 
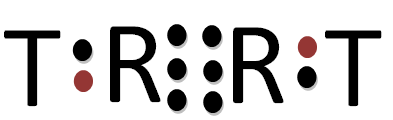
Dari struktur tersebut, diketahui bahwa  membentuk ikatan rangkap tiga antara R dengan R, dan jumlahnya sesuai dengan kaidah oktet. Pada senyawa
membentuk ikatan rangkap tiga antara R dengan R, dan jumlahnya sesuai dengan kaidah oktet. Pada senyawa  tidak bisa dibuat strukturnya karena unsur Q sudah memiliki 8 elektron terluar.
tidak bisa dibuat strukturnya karena unsur Q sudah memiliki 8 elektron terluar.
B.
Senyawa  dan
dan  tidak bisa dibuat strukturnya karena unsur Q sudah stabil dan memiliki 8 elektron terluar
tidak bisa dibuat strukturnya karena unsur Q sudah stabil dan memiliki 8 elektron terluar
C.

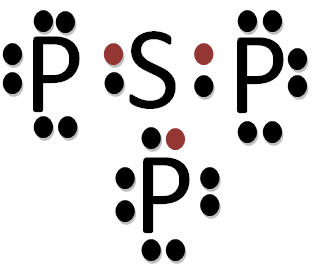
Senyawa  menyimpang dari kaidah oktet karena pada kedua senyawa, S hanya memiliki 6 elektron terluar setelah berikatan.
menyimpang dari kaidah oktet karena pada kedua senyawa, S hanya memiliki 6 elektron terluar setelah berikatan.
D. 
Senyawa  sudah sesuai dengan kaidah oktet. Sedangkan senyawa
sudah sesuai dengan kaidah oktet. Sedangkan senyawa  tidak bisa dibuat strukturnya karena melibatkan unsur Q yang telah stabil.
tidak bisa dibuat strukturnya karena melibatkan unsur Q yang telah stabil.
E. TP dan 

Senyawa  tidak bisa dibuat strukturnya karena ada unsur Q. Senyawa TP juga sesuai aturan oktet.
tidak bisa dibuat strukturnya karena ada unsur Q. Senyawa TP juga sesuai aturan oktet.
Berdasarkan penjelasan tersebut, jawaban yang tepat adalah C.