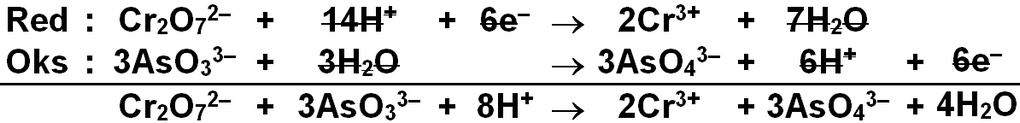Iklan
Pertanyaan
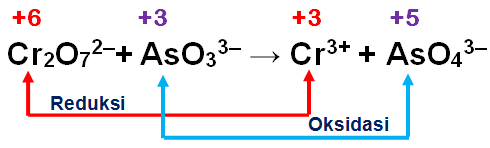
Perhatikan reaksi redoks berikut ini! Cr 2 O 7 2 − ( a q ) + AsO 3 3 − ( a q ) → Cr 3 + ( a q ) + AsO 4 3 − ( a q ) Setelah reaksi disetarakan, perbandingan banyaknya mol ion Cr 2 O 7 2 − dengan AsO 4 3 − dalam reaksi tersebut adalah ...
Perhatikan reaksi redoks berikut ini!
Setelah reaksi disetarakan, perbandingan banyaknya mol ion dengan dalam reaksi tersebut adalah ...
1 : 3
1 : 4
2 : 3
3 : 2
1 : 8
Iklan
BR
B. Rohmawati
Master Teacher
Mahasiswa/Alumni Universitas Negeri Semarang
Jawaban terverifikasi
3
4.7 (13 rating)
EL
Efa Latri
Makasih ❤️
SF
Syaira Fatiha Maula
Makasih ❤️
AD
Azzahrotul Dinda Setiawati
Pembahasan tidak menjawab soal
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia