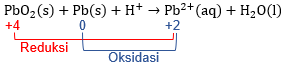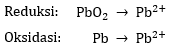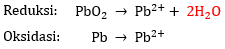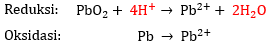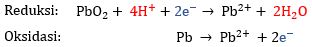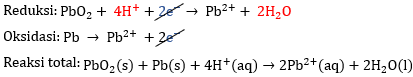Pada reaksi di atas, terdapat ion H+ pada reaktan, artinya reaksi berlangsung dalam medium asam. Langkah penyetaraan reaksi redoks dengan metode setengah reaksi dalam medium asam adalah sebagai berikut.
1) Menuliskan persamaan reaksi reduksi dan oksidasi
Reaksi reduksi disertai dengan penurunan biloks, sedangkan reaksi oksidasi disertai dengan kenaikan biloks.
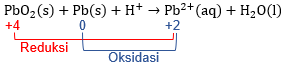
Reaksi terpisah dapat dituliskan sebagai berikut.
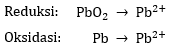
2) Menyetarakan atom utama (selain atom O dan H)
Pada reaksi reduksi dan oksidasi, jumlah atom Pb pada ruas kiri dan ruas kanan sudah sama sehingga tidak ada perubahan koefisien.
3) Menyetarakan atom O dan H
- Tambahkan H2O pada ruas yang kekurangan atom O.
Pada reaksi reduksi, terdapat 2 atom O pada ruas kiri saja sehingga perlu menambahkan 2 H2O di ruas kanan agar jumlah atom O-nya sama. Sedangkan pada reaksi oksidasi, tidak ada atom O pada kedua ruas.
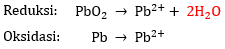
- Tambahkan ion H+ pada ruas yang kekurangan atom H.
Pada reaksi reduksi, terdapat 4 atom H pada ruas kanan saja sehingga perlu menambahkan 4 ion H+ pada ruas kiri agar jumlah atom H-nya sama. Sedangkan pada reaksi oksidasi, tidak ada atom H pada kedua ruas.
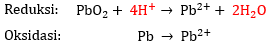
4) Menyetarakan jumlah muatan
Pada langkah ini, tambahkan elektron untuk menyetarakan muatan di ruas kiri dan kanan.
Pada reaksi reduksi, jumlah muatan di ruas kiri adalah +4 dan di ruas kanan adalah +2. Agar muatan pada kedua ruas sama, tambahkan 2e− pada ruas kiri.
Pada reaksi oksidasi, jumlah muatan di kiri adalah +2 dan di ruas kanan. Agar muatan pada kedua ruas sama, tambahkan 2e− pada ruas kanan.
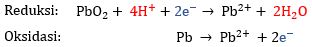
5) Menjumlahkan reaksi dengan mengeleminasi elektron
Pada kedua reaksi, masing-masing memiliki jumlah elektron yang sama, yaitu 2 sehingga dapat langsung dieliminasi.
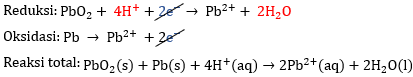
Reduktor adalah spesi yang mengalami oksidasi, yaitu Pb. Hasil oksidasinya adalah Pb2+. Perbandingan koefisien reduktor dan hasil oksidasinya adalah 1 : 2.
Jadi, jawaban yang tepat adalah opsi C.