Iklan
Pertanyaan
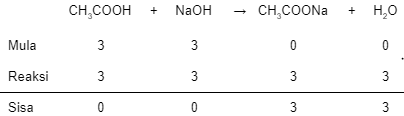
Perhatikan grafik titrasi asam lemah oleh basa kuat berikut! Jika sebanyak 20 mL CH 3 COOH dititrasi menggunakan larutan NaOH 0,05 M. Maka tentukan : Konsentrasi larutan pH larutan pada titik C
Perhatikan grafik titrasi asam lemah oleh basa kuat berikut!
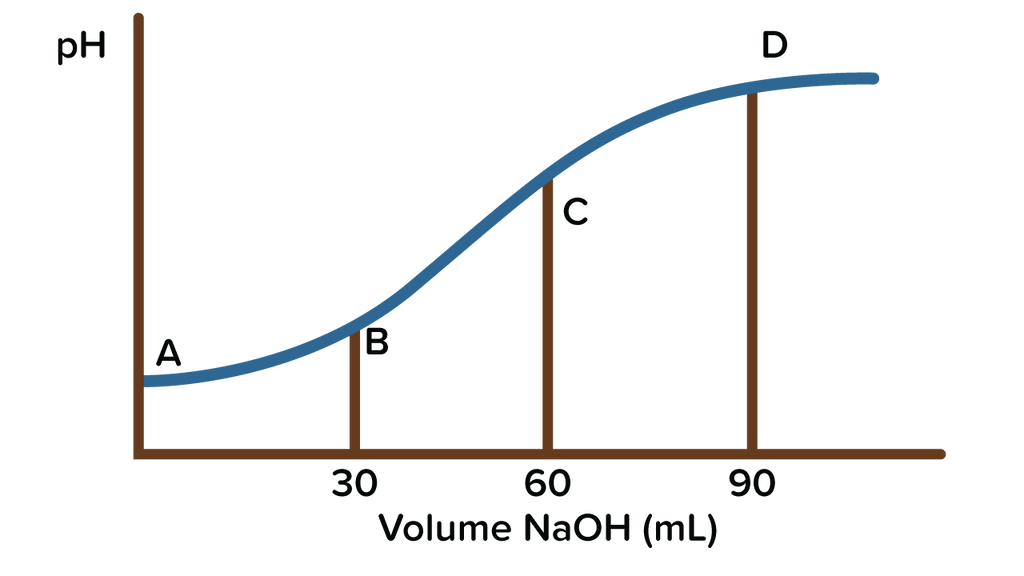
Jika sebanyak 20 mL dititrasi menggunakan larutan NaOH 0,05 M. Maka tentukan :
- Konsentrasi larutan
- pH larutan pada titik C
Iklan
K. Nurul
Master Teacher
Mahasiswa/Alumni Universitas Lambung Mangkurat
3
4.4 (7 rating)
Endah Ulfi Rosaidah
Pembahasan lengkap banget Ini yang aku cari! Mudah dimengerti Bantu banget Makasih ❤️
Mohammad Farras Prasandha
Mudah dimengerti
Zaki Akmal Fadhil
Jawaban tidak sesuai Pembahasan tidak menjawab soal Pembahasan terpotong salah di akar
Iklan
Pertanyaan serupa
Tanya ke AiRIS
Yuk, cobain chat dan belajar bareng AiRIS, teman pintarmu!
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia