Iklan
Pertanyaan
Perhatikan grafik berikut. Pada grafik tersebut ditunjukkan titik didih beberapa senyawa terhadap massa molekul atau massa rumusnya ( M r ). Lakukan analisis pada grafik tersebut dengan acuan pertanyaan-pertanyaan berikut. Mengapa grafik kelompok senyawa CH 4 berbeda dengan yang lain? Bagaimana kecenderungan titik didih senyawa pada kelompoknya saat massa molekulnya meningkat? Senyawa apakah yang massa molekulnya kecil, tetapi memiliki titik didih tinggi? Mengapa demikian? Buat simpulan dari grafik tersebut berdasarkan hasil analisis yang telah dilakukan.
Perhatikan grafik berikut.
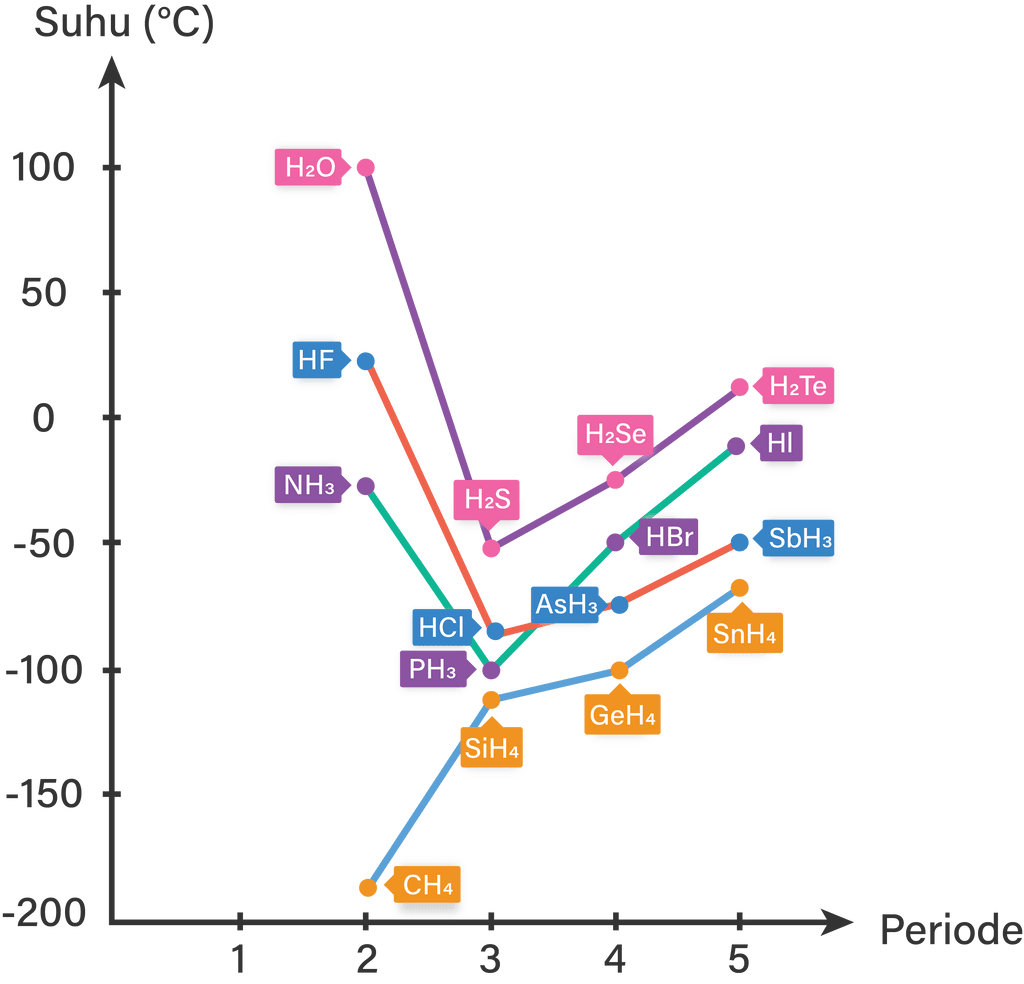
Pada grafik tersebut ditunjukkan titik didih beberapa senyawa terhadap massa molekul atau massa rumusnya (). Lakukan analisis pada grafik tersebut dengan acuan pertanyaan-pertanyaan berikut.
- Mengapa grafik kelompok senyawa CH4 berbeda dengan yang lain?
- Bagaimana kecenderungan titik didih senyawa pada kelompoknya saat massa molekulnya meningkat?
- Senyawa apakah yang massa molekulnya kecil, tetapi memiliki titik didih tinggi? Mengapa demikian?
Buat simpulan dari grafik tersebut berdasarkan hasil analisis yang telah dilakukan.
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
10
3.3 (3 rating)
NA
Nadhira Aqila Safira
Pembahasan terpotong
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















