Asam halida adalah senyawa asam yang anionnya merupakan unsur-unsur halida (golongan VIIA). Titik didih senyawa adalah suhu pada saat molekul-molekul zat cair mulai berubah menjadi gas (merenggangkan interaksi antar molekulnya) pada tekanan tertentu. Pada pemanasan diperlukan energi untuk mengatasi gaya tarik antarmolekul dalam zat cair. Makin kuat gaya tarik antarmolekul, makin tinggi titik didihnya. Idealnya, semakin luas permukaan molekul, makin kuat gaya dispersi antarmolekul, maka titik didihnya semakin tinggi.
Jika ditinjau dari jari-jari atom unsur dalam satu golongan, dari atas ke bawah jari-jarinya semakin besar dan berat molekulnya semakin besar. Artinya titik didih senyawa asam halida seharusnya meningkat dari HF hingga HI. Namun, ternyata titik didih HF adalah yang tertinggi diantara asam halida, kemudian baru HI, HBr, dan yang terkecil adalah HCl. Ternyata kekuatan interaksi antar molekul juga mempengaruhi kuatnya interaksi antar molekul. Interaksi molekul kovalen ini tergantung pada kepolaran molekul, yang dibagi menjadi tiga jenis, yaitu gaya London (gaya dispersi), ikatan dipol-dipol, dan ikatan hidrogen. Ikatan hidrogen adalah interaksi antarmolekul yang terjadi antara atom hidrogen dengan unsur-unsur yang sangat elektronegatif, yaitu F, O, dan N. Oleh sebab itu, HF memiliki titik didih yang tertinggi (karena ikatan H dengan F antarmolekulnya). Sehingga urutan titik didihnya menjadi:
HF > HI > HBr > HCl
Hal yang sama akan terjadi pada asam yang anionnya adalah golongan VIA dan VA karena interaksi H dengan O (golongan VI A) antarmolekul pada senyawa  dan H dengan N (golongan VA) pada
dan H dengan N (golongan VA) pada  merupakan ikatan hidrogen. Sedangkan H dengan C (golongan IVA) tidak mengalami hal demikian karena ini bukan termasuk ikatan hidrogen, sehingga kecenderungannya adalah titik didih semakin tinggi dengan bertambahnya berat molekul. Grafik titik didih senyawa tersebut adalah sebagai berikut:
merupakan ikatan hidrogen. Sedangkan H dengan C (golongan IVA) tidak mengalami hal demikian karena ini bukan termasuk ikatan hidrogen, sehingga kecenderungannya adalah titik didih semakin tinggi dengan bertambahnya berat molekul. Grafik titik didih senyawa tersebut adalah sebagai berikut:
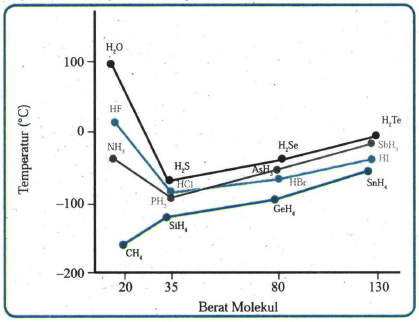
Jadi, urutan molekul-molekul asam halida adalah HF > HI > HBr > HCl.


















