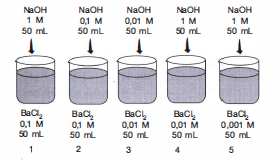
Untuk menentukan gambar yang menunjukkan terjadinya endapan, kita harus menghitung nilai  dari masing-masing gambar. Dalam perhitungan
dari masing-masing gambar. Dalam perhitungan  kita membutuhkan data konsentrasi ion-ion dari endapan, yaitu
kita membutuhkan data konsentrasi ion-ion dari endapan, yaitu  dan
dan  . Kita bisa menghitung konsentrasi tersebut dari perhitungan konsentrasi larutan
. Kita bisa menghitung konsentrasi tersebut dari perhitungan konsentrasi larutan  dan juga
dan juga  menggunakan perhitungan molaritas pengenceran. Berdasarkan gambar, diketahui volume awal masing-masing larutan adalah 50 mL, kemudian ketika dicampurkan menjadi 100 mL, maka persamaan yang kita gunakan adalah
menggunakan perhitungan molaritas pengenceran. Berdasarkan gambar, diketahui volume awal masing-masing larutan adalah 50 mL, kemudian ketika dicampurkan menjadi 100 mL, maka persamaan yang kita gunakan adalah  .
.
Setelah ditentukan konsentrasi ion  dan juga
dan juga  , kita bisa menentukan nilai
, kita bisa menentukan nilai  dengan perhitungan berikut:
dengan perhitungan berikut:

Perhitungan nilai  pada gambar 1
pada gambar 1
Perhitungan konsentrasi  pada pengenceran
pada pengenceran


Dari reaksi tersebut diketahui konsentrasi  adalah 0,5 M.
adalah 0,5 M.
Perhitungan konsentrasi  pada pengenceran
pada pengenceran


Dari reaksi tersebut diketahui konsentrasi dari  adalah 0,05 M.
adalah 0,05 M.
Penentuan nilai 

Pada soal diketahui nilai  , maka kita dapat simpulkan pada gambar 1 nilai
, maka kita dapat simpulkan pada gambar 1 nilai  dan endapan akan terbentuk.
dan endapan akan terbentuk.
Apabila kita lakukan perhitungan yang sama pada gambar 2,3,4, dan 5 maka kita dapatkan hasil bahwa dari kelima gambar tersebut, gambar yang menunjukkan terjadinya endapan adalah gambar 1 saja.
Jadi, jawaban yang benar adalah D.