Iklan
Pertanyaan
Perhatikan gambar berikut! Berdasarkan Hukum Hess, tentukan energi kisi dari NaCl melalui perubahan entalpi yang ditanyakan!
Perhatikan gambar berikut!
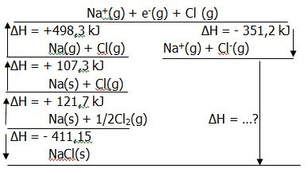
Berdasarkan Hukum Hess, tentukan energi kisi dari NaCl melalui perubahan entalpi yang ditanyakan!
-35.05 kJ
-787.25 kJ
-182.15 kJ
-640.15 kJ
+35.05 kJ
Iklan
SH
S. Hidayati
Master Teacher
Mahasiswa/Alumni Universitas Indonesia
Jawaban terverifikasi
4
5.0 (1 rating)
KC
Kevin Christopher
Pembahasan lengkap banget
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















