Iklan
Pertanyaan
Perhatikan diagram berikut: Diagram tersebut menyatakan bahwa ....
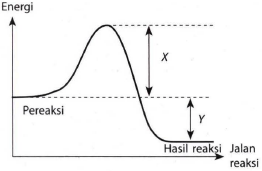
Perhatikan diagram berikut:
Diagram tersebut menyatakan bahwa ....
Reaksi berlangsung dengan menyerap energi.
X adalah perubahan entalpi reaksi.
Reaksi hanya dapat berlangsung jika X>Y.
Reaksi tersebut adalah reaksi eksoterm.
X+ Y adalah energi aktivasi.
Iklan
MR
M. Rani
Master Teacher
Mahasiswa/Alumni Universitas Brawijaya
Jawaban terverifikasi
23
4.2 (7 rating)
DC
DINA CLARITA SITUMORANG
waban tidak sesuai gambarnya berbeda, garis si x itu berada di lingkaran nya Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2025 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia