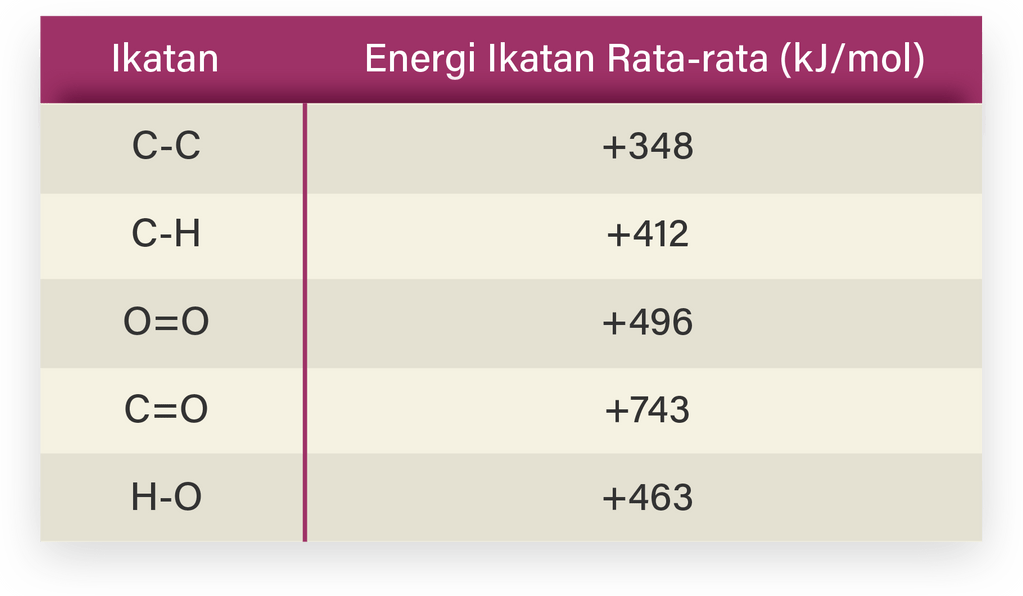
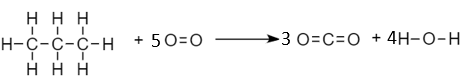Salah satu cara menentukan perubahan entalpi adalah dengan menggunakan data energi ikatan. Energi ikatan adalah perubahan entalpi yang menyertai reaksi pemutusan satu mol ikatan kovalen menjadi atom-atornnya pada fase gas. Reaksi kimia dapat dipandang sebagai perubahan kimia yang terjadi melalui tahap pemutusan ikatan kimia antar atom-atom dari zat-zat pereaksi dan dilanjutkan dengan tahap pembentukan ikatan kimia zat-zat produk reaksi. Untuk menghitung nilai perubahan entalpi dengan data energi ikatan, rumus yang digunakan adalah:
△H=∑energi pemutusan ikatan (reaktan)−∑energi pembentukan ikatan (produk)
Reaksi yang ada pada soal adalah reaksi pembakaran sempurna gas propana:
C3H8+5O2→3CO2+4H2O
Reaksi pembakaran tergolong pada reaksi eksoterm, sehingga memiliki perubahan entalpi yang bernilai negatif karena melepaskan kalor ke lingkungan (suhu naik). Sebelum menentukan besarnya perubahan entalpi reaksi, perlu untuk membuat rantai senyawa yang ada pada reaksi untuk mengetahui ikatannya:
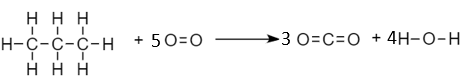
Besarnya perubahan entalpi reaksi pembakaran sempurna gas propana adalah:
△H=====∑energi pemutusan ikatan (reaktan)−∑energi pembentukan ikatan (produk)(2×(C−C)+8×(C−H)+5×(O=O))−(3×2×(C=O)+4×2×(H−O))(2×(348)+8×(412)+5×(496))−(6×(743)+8×(463))6.472−8.162−1.690 kJ/mol
Perhitungan tersebut menunjukkan bahwa energi pemutusan ikatan (reaktan) lebih kecil daripada energi pembentukan ikatan (produk).
Pada opsi 3 dinyatakan bahwa besarnya entalpi reaksi pembakaran 2 gram gas propana adalah 84,5 kJ, maka untuk membuktikan dapat dengan menghitung mol propana dan dibandingkan dengan perubahan entalpi propana per mol.
mol propana=====Mrm3(Ar C)+8(Ar H)23(12)+8(1)24420,045 mol
Perubahan entalpi propana pada 0,045 mol adalah:
△H==−1.690 kJ/mol×0,045 mol−76,05 kJ
Berdasarkan keterangan dan perhitungan di atas, maka pernyataan yang benar adalah energi yang dibutuhkan untuk memutuskan ikatan propana dan O2 lebih kecil dibanding energi yang dihasilkan pada pembentukan produk.
Jadi, jawaban yang benar adalah B.