Iklan
Pertanyaan
Pembuatan urea ( H 2 NCONH 2 ) dalam industri dilakukan dengan mereaksikan amonia dan gas karbondioksida. Reaksi berlangsung dalam dua tahapan reaksi sebagai berikut. Nilai x adalah sebesar .... Diketahui: △ H f 0 + 4 m u NH 3 ( g ) = − 46 kJ / mol ; △ H f 0 CO 2 ( g ) = − 393 , 5 kJ / mol ; △ H f 0 H 2 O ( l ) = − 285 , 9 kJ / mol ; △ H vap 0 H 2 O = 40 , 65 kJ / mol ; △ H f 0 H 2 NCOONH 2 ( s ) = − 333 , 19 kJ / mol
Pembuatan urea () dalam industri dilakukan dengan mereaksikan amonia dan gas karbondioksida. Reaksi berlangsung dalam dua tahapan reaksi sebagai berikut.
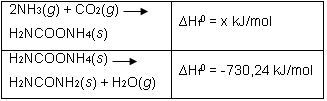
Nilai x adalah sebesar ....
Diketahui:
-117,00
152,69
597,03
637,68
923,58
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
1
5.0 (2 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia















