Iklan
Pertanyaan
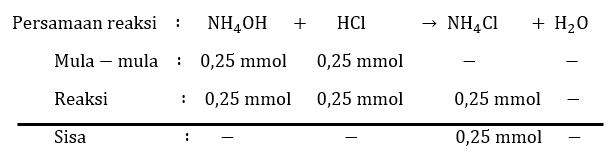
Pada titrasi 25 mL NH 4 OH 0,01 M oleh HCl 0,01 M, titik akhir terjadi setelah penambahan 25 mL HClTentukan pH pada titik akhir titrasi dan sifat larutan! ( K h = 5 × 1 0 − 10 ) .
Pada titrasi 25 mL 0,01 M oleh HCl 0,01 M, titik akhir terjadi setelah penambahan 25 mL HCl Tentukan pH pada titik akhir titrasi dan sifat larutan! .
Iklan
Q'
Q. 'Ainillana
Master Teacher
Mahasiswa/Alumni Universitas Negeri Yogyakarta
Jawaban terverifikasi
8
3.6 (3 rating)
bA
berlian Arta m purba
Makasih ❤️ Mudah dimengerti
MR
Muhamad Rafli arkananta
Jawaban tidak sesuai
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia