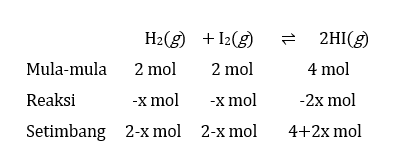Iklan
Pertanyaan
Pada T °C, nilai tetapan kesetimbangan reaksi: H 2 ( g ) + I 2 ( g ) ⇌ 2 HI ( g ) adalah 25. Pada percobaan, sebanyak 2 mol H 2 , 2 mol I 2 , dan 4 mol HI dicampurkan dalam ruang 2 liter. Hal yang terjadi adalah...
Pada T°C, nilai tetapan kesetimbangan reaksi:
adalah 25.
Pada percobaan, sebanyak 2 mol H2 , 2 mol I2 , dan 4 mol HI dicampurkan dalam ruang 2 liter. Hal yang terjadi adalah...
campuran tersebut dalam keadaan setimbang
reaksinya spontan ke kanan
pada saat H2 tinggal 1 mol, tercapai keadaan setimbang
pada saat I2 tinggal 1,5 mol; tercapai keadaan setimbang
pada saat HI terbentuk 5 mol, tercapai keadaan setimbang
Iklan
AY
A. Yulanda
Master Teacher
Mahasiswa/Alumni Universitas Lampung
Jawaban terverifikasi
4
0.0 (0 rating)
Iklan
Pertanyaan serupa
RUANGGURU HQ
Jl. Dr. Saharjo No.161, Manggarai Selatan, Tebet, Kota Jakarta Selatan, Daerah Khusus Ibukota Jakarta 12860
Produk Ruangguru
Bantuan & Panduan
Hubungi Kami
©2026 Ruangguru. All Rights Reserved PT. Ruang Raya Indonesia